题目内容
下列说法错误的是
| A.化学可以识别、改变和创造分子 |
| B.在化学反应中,反应前后电子总数可能发生变化 |
| C.摩尔是一个单位,用于计量物质所含微观粒子的多少 |
| D.在化学反应中,反应前后原子种类、原子数目和质量一定不变 |
B
解析试题分析:A、分子是保持物质化学性质的微粒,因此在化学变化中分子是可以再分的,所以化学可以识别、改变和创造分子,A正确;B、在化学反应中,反应前后电子总数必须是守恒的,不可能发生变化,B不正确;C、摩尔是物质的量的单位,用于计量物质所含微观粒子的多少,C正确;D、原子是化学变化中的最小微粒,所以在化学反应中,反应前后原子种类、原子数目和质量一定不变,即一定满足质量守恒定律,D正确,答案选B。
考点:考查化学变化、原子、分子的性质

练习册系列答案
相关题目
重水(D2O)是重要的核工业原料,下列说法错误的是
| A.1H与D互称同位素 | B.1H→D通过化学变化不能实现 |
| C.H2O与D2O互称同素异形体 | D.1H218O与D216O的物理性质不同 |
不同元素的原子间最本质的区别是
| A.中子数不同 | B.相对原子质量不同 |
| C.质子数不同 | D.最外层电子数不同 |
某同学设计如下元素周期表,以下说法正确的是
| A.X、Y、Z元素分别为N、P、O |
| B.白格中都是主族元素,灰格中都是副族元素 |
| C.原子半径:Z>X>Y |
| D.X、Y、Z的气态氢化物中最稳定的是:Z的氢化物 |
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 原子半径/nm | 0.186 | 0.102 | 0.152 | 0.074 |
| 主要化合价 | +1 | +6、-2 | +1 | -2 |
下列叙述不正确的是
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其盐溶液的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
硫化氢分子中,形成共价键的原子轨道是
| A.硫原子的2p轨道和氢原子的1s轨道 |
| B.硫原子的2p轨道和氢原子的2p轨道 |
| C.硫原子的3p轨道和氢原子的1s轨道 |
| D.硫原子的2p轨道和氢原子的3p轨道 |
重水 是重要的核工业原料,下列关于D原子的说法错误的是
是重要的核工业原料,下列关于D原子的说法错误的是
A.氘 原子核外有1个电子 原子核外有1个电子 | B.是H的同位素 |
| C.自然界中没有D原子存在 | D.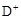 质量数为2 质量数为2 |
R为短周期元素,其原子所具有的电子层数为最外层电子数的一半。下列说法中不正确的是
| A.当它形成含氧酸根离子R2O42—时,也可以形成RO32— |
| B.当它形成含氧酸根离子RO42—时,还可以形成HRO3— |
| C.当它形成含氧酸根离子RO4—时,还可以形成RO3— |
| D.当它形成含氧酸根离子R2O72—时,也可以形成RO42— |
下列关于元素性质和结构的递变情况的说法错误的是( )
| A.Li、Be、B原子最外层电子数依次增多 |
| B.P、S、Cl元素最高正价依次升高 |
| C.N、O、F原子半径依次增大 |
| D.Na、K、Rb的电子层数逐渐增多 |