题目内容
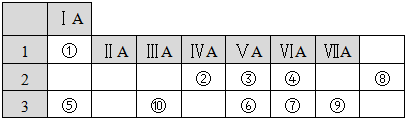
下表列出了①~⑩九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④在周期表中所处位置 ,从元素原子得失电子的角度看,元素④具有 性(填“氧化性”或“还原性”).
(2)按气态氢化物的稳定性由弱到强的顺序排列,④⑥⑦的氢化物稳定性: (写氢化物的化学式).
(3)元素⑨的原子结构示意图是 .
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式 ,这一反应是 (填“吸热”或“放热”)反应.
(5)用电子式表示①与⑨反应得到的化合物的形成过程 .
(6)元素⑩的最高价氧化物的水化物呈 性.
(7)元素⑤的最高价氧化物的水化物与元素⑩的最高价氧化物的水化物反应的离子方程式为: .

请按要求回答下列问题.
(1)元素④在周期表中所处位置
(2)按气态氢化物的稳定性由弱到强的顺序排列,④⑥⑦的氢化物稳定性:
(3)元素⑨的原子结构示意图是
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式
(5)用电子式表示①与⑨反应得到的化合物的形成过程
(6)元素⑩的最高价氧化物的水化物呈
(7)元素⑤的最高价氧化物的水化物与元素⑩的最高价氧化物的水化物反应的离子方程式为:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由①~⑩九种元素在周期表中的位置可知,①~⑨分别是:H、C、N、O、Na、P、S、Ne、Cl、Al,由此分析解答.
解答:
解:(1)元素④在周期表中所处位置第二周期第ⅥA族,从元素原子得失电子的角度看,元素④是O具有得电子能力,具有氧化性,故答案为:第二周期第ⅥA族,氧化性;
(2)非金属性越强气态氢化物的越稳定,非金属性由弱到强的顺序为⑥<⑦<④,氢化物稳定性:PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(3)元素⑨是氯,氯的原子结构示意图是 ,故答案为:
,故答案为: ;
;
(4)写出钠在氧气中燃烧的化学方程式2Na+O2
Na2O2,可燃物的燃烧是放热反应,故答案为:2Na+O2
Na2O2,放热;
(5)HCl是氢原子和氯原子通过共价键形成的极性分子,其形成过程是:H?+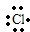 →
→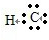 ,故答案为:H?+
,故答案为:H?+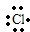 →
→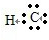 ;
;
(6)元素⑩是铝,铝的最高价氧化物的水化物是氢氧化铝,呈两性,故答案为:两性;
(7)元素⑤是钠,钠的最高价氧化物的水化物是氢氧化钠与元素⑩是铝的最高价氧化物的水化物是氢氧化铝,两反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
(2)非金属性越强气态氢化物的越稳定,非金属性由弱到强的顺序为⑥<⑦<④,氢化物稳定性:PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(3)元素⑨是氯,氯的原子结构示意图是
 ,故答案为:
,故答案为: ;
;(4)写出钠在氧气中燃烧的化学方程式2Na+O2
| ||
| ||
(5)HCl是氢原子和氯原子通过共价键形成的极性分子,其形成过程是:H?+
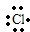 →
→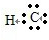 ,故答案为:H?+
,故答案为:H?+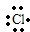 →
→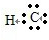 ;
;(6)元素⑩是铝,铝的最高价氧化物的水化物是氢氧化铝,呈两性,故答案为:两性;
(7)元素⑤是钠,钠的最高价氧化物的水化物是氢氧化钠与元素⑩是铝的最高价氧化物的水化物是氢氧化铝,两反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查元素周期律和周期表的综合应用,涉及的知识点多,面广,但难适中.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
以下原子轨道符号不正确的是( )
| A、1s | B、3d | C、2f | D、2p |
下列方法中可以说明2HI(g)?H2(g)+I2(g)已达到平衡的是( )
| A、c(HI):c(H2):c(I2)=2:1:1时 |
| B、温度和体积一定时,混合气体的颜色不再改变 |
| C、单位时间内生成n mol H2的同时消耗2n mol HI |
| D、温度和体积一定时,容器内压强不再变化 |
 A、B、C和铜关系如图:
A、B、C和铜关系如图: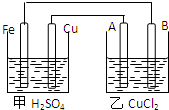 据图回答以下问题:
据图回答以下问题: