题目内容
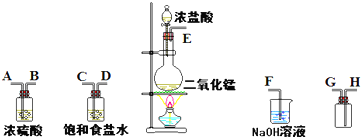
 实验中常用MnO2与浓盐酸反应制取氯气,实验装置如图所示.
实验中常用MnO2与浓盐酸反应制取氯气,实验装置如图所示.请回答:
(1)写出圆底烧瓶中发生反应的化学方程式
(2)该方法所制得的Cl2中通常含有的杂质是
(3)在淀粉碘化钾溶液中通入少量氯气,溶液由无色变为
(4)在实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可向烧瓶中加入
分析:(1)实验室中制备氯气的方法是利用固体二氧化锰和浓盐酸加热反应得到;
(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢和水蒸气;
(3)氯气具有氧化性,通入碘化钾溶液中生成碘单质,遇到淀粉变蓝;
(4)氯气有毒不能排放空气中,烧瓶中残留的氯气可以加入氢氧化钠溶液吸收.
(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢和水蒸气;
(3)氯气具有氧化性,通入碘化钾溶液中生成碘单质,遇到淀粉变蓝;
(4)氯气有毒不能排放空气中,烧瓶中残留的氯气可以加入氢氧化钠溶液吸收.
解答:解:(1)实验室中制备氯气的方法是利用固体二氧化锰和浓盐酸加热反应得到,反应的化学方程式为MnO2+4HCl
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢和水蒸气,故答案为:HCl;H2O;
(3)氯气具有氧化性,通入碘化钾溶液中生成碘单质,Cl2+2I-=I2+2Cl-,I2遇到淀粉变蓝,反应证明氯气具有氧化性,故答案为:蓝;氧化;
(4)氯气有毒不能排放空气中,在实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可向烧瓶中加入氢氧化钠溶液吸收,Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:氢氧化钠.
| ||
故答案为:MnO2+4HCl
| ||
(2)浓盐酸易挥发,所以制备的氯气中含有氯化氢和水蒸气,故答案为:HCl;H2O;
(3)氯气具有氧化性,通入碘化钾溶液中生成碘单质,Cl2+2I-=I2+2Cl-,I2遇到淀粉变蓝,反应证明氯气具有氧化性,故答案为:蓝;氧化;
(4)氯气有毒不能排放空气中,在实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可向烧瓶中加入氢氧化钠溶液吸收,Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:氢氧化钠.
点评:本题考查了实验室制备的实验分析判断,主要是氯气性质的分析应用,注意氯气有毒需要用氢氧化钠溶液吸收,题目较简单.

练习册系列答案
相关题目

 (2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
(2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).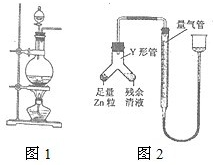 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).