题目内容
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是
| A.2F2+2H2O=4HF+O2↑ | B.C+H2O CO+H2 CO+H2 |
| C.2Na+2H2O=2NaOH+H2↑ | D.3NO2+H2O=2HNO3+NO |
D
解析试题分析:A、水作还原剂;B、水作氧化剂;C、水作氧化剂;D、得失电子的都是二氧化氮,水既不是氧化剂也不是还原剂。
考点:考查氧化还原反应,与水有关的反应。

练习册系列答案
相关题目
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下: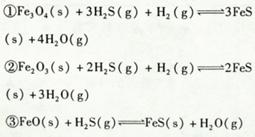
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是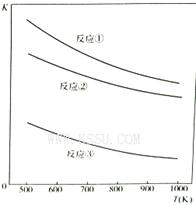
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
下列化学应用中不涉及氧化还原反应的是
| A.Na2S水溶液在空气中变浑浊 |
| B.生活中使用明矾净水,除去水中的悬浮颗粒 |
| C.溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D.漂白粉漂白有色布条 |
一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L, 测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol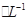 |
C.反应后溶液中c(NO3-)=1.6mol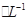 |
| D.反应后的溶液最多还能溶解1.6lgFe |
C和CuO在高温下反应可能生成Cu、Cu2O、CO2、CO。现将1 g碳粉跟8 g CuO混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为1.1 g,残余气体在标准状况下的体积为560 mL。下列说法错误的是( )
| A.在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 |
| B.试管中发生的所有氧化还原反应共转移电子0.15 mol |
| C.反应后试管中剩余的固体混合物的总质量为7.2 g |
| D.反应生成铜和氧化亚铜的总物质的量为0.1 mol |
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为( )
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
下列叙述正确的是( )。
| A.阳离子只有氧化性,阴离子只有还原性 |
| B.含氧酸可作氧化剂而无氧酸不能 |
| C.在8NH3+3Cl2=N2+6NH4Cl反应中氧化剂与还原剂物质的量之比是2∶3 |
| D.已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-=2Fe2++Br2不易进行 |
根据表中信息,判断下列叙述中正确的是 ( )。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+5H2O2+6H+=2Mn2++5O2↑+8H2O
有Fe2+、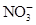 、Fe3+、
、Fe3+、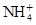 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8∶1 |
B.还原产物为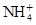 |
C.若有1 mol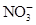 参加还原反应,转移8 mol e- 参加还原反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |