题目内容
根据下列某些短周期元素的性质回答问题:
(1)K、V、R三种元素形成的简单离子的半径由大到小的顺序是 (用离子符号表示).
(2)K、L、R、Q、V五种元素可形成化学式为K2R2、L2R2、K2R、L2Q、QV2、Q2V2、V2R等化合物:
①K2R2的电子式为 ;
②Q2V2的结构式为 ;
③用电子式表示K2R的形成过程 .
(3)KRL与XR2反应中断裂的化学键类型有 (填选项).
A.氢键 B.离子键 C.极性键 D.非极性键
(4)将QR2与V2通入水中,发生反应的离子方程式为: ;X与Q的最高价氧化物的水化物的浓溶液反应的化学方程式为: .
(5)向由M、V两种元素组成的化合物溶液400mL 1mol/L中加入500mL一定物质的量浓度的KOH溶液,得到白色沉淀15.6g,则KOH溶液的物质的量浓度为 mol/L或 mol/L.
| 元素代号 | K | L | M | Q | R | T | V | X |
| 原子半 径/nm | 0.183 | 0.102 | 0.152 | 0.099 | 0.077 | |||
| 主要化 合价 | +6 -2 | +1 | +7 -1 | |||||
| 其他 | 焰色反应呈黄色 | 阳离子核外无电子 | 最高价氧化物的水化物具有两性 | 最外层电子数是次外层的3倍 | 同周期中非金属性最强 | 最高正价和最低负价之和为0 |
(2)K、L、R、Q、V五种元素可形成化学式为K2R2、L2R2、K2R、L2Q、QV2、Q2V2、V2R等化合物:
①K2R2的电子式为
②Q2V2的结构式为
③用电子式表示K2R的形成过程
(3)KRL与XR2反应中断裂的化学键类型有
A.氢键 B.离子键 C.极性键 D.非极性键
(4)将QR2与V2通入水中,发生反应的离子方程式为:
(5)向由M、V两种元素组成的化合物溶液400mL 1mol/L中加入500mL一定物质的量浓度的KOH溶液,得到白色沉淀15.6g,则KOH溶液的物质的量浓度为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:K焰色反应呈黄色,应为Na元素,L阳离子核外无电子,为H元素,M最高价氧化物的水化物具有两性,应为Al元素,Q化合价有-2价、+6价,应为S元素,R最外层电子数是次外层的3倍,应为O元素,T化合价为+1价,且原子半径比Na小,应为Li元素,V化合价有-1价、+7价,为Cl元素,X最高正价和最低负价之和为0,应为ⅣA族元素,原子半径小于Li,应为C元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答:
解:K焰色反应呈黄色,应为Na元素,L阳离子核外无电子,为H元素,M最高价氧化物的水化物具有两性,应为Al元素,Q化合价有-2价、+6价,应为S元素,R最外层电子数是次外层的3倍,应为O元素,T化合价为+1价,且原子半径比Na小,应为Li元素,V化合价有-1价、+7价,为Cl元素,X最高正价和最低负价之和为0,应为ⅣA族元素,原子半径小于Li,应为C元素,
(1)Cl-核外有3个电子层,O2-、Na+核外电子层数都为2,核外电子层数越多,半径越大,具有相同核外电子排布的离子,核电荷数越大离子半径越小,则离子半径大小顺序为Cl->O2->Na+,故答案为:Cl->O2->Na+;
(2)①Na2O2,为离子化合物,含有过氧键,电子式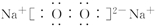 ,故答案为:
,故答案为: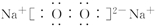 ;
;
②S2Cl2的各原子核外电子数都为8电子稳定结构,结构式为Cl-S-S-Cl,故答案为:Cl-S-S-Cl;
③用电子式表示Na2O的形成过程为 ,故答案为:
,故答案为: ;
;
(3)NaOH与CO2反应生成碳酸钠和水,反应中断裂的化学键类型有极性共价键和离子键,故答案为:B、C;
(4)SO2与Cl2通入水中,发生氧化还原反应生成盐酸和硫酸,反应的离子方程式为SO2+Cl2+2H2O=4H++2Cl-+SO42-,
X与S的最高价氧化物的水化物的浓溶液反应的化学方程式为C+2H2SO4(浓)
CO2+2SO2↑+2H2O,
故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42-;C+2H2SO4(浓)
CO2+2SO2↑+2H2O;
(5)向由Al、Cl两种元素组成的化合物溶液400mL 1mol/L中加入500mL一定物质的量浓度的NaOH溶液,则可知n(AlCl3)=0.4L×1mol/L=0.4mol,如完全生成沉淀,则应生成0.4molAl(OH)3,得到白色沉淀15.6g,即
=0.2mol,
说明Al3+没有完全生成沉淀,可能存在两种情况:
①NaOH不足,只发生Al3++3OH-=Al(OH)3↓,
0.2mol 0.6mol 0.2mol
此时V(NaOH)=
=1.2mol/L,
②如NaOH部分过量,先后发生:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,
0.4mol 1.2mol 0.4mol 0.2mol 0.2mol
则V(NaOH)=
=2.8mol/L,
故答案为:1.2;2.8.
(1)Cl-核外有3个电子层,O2-、Na+核外电子层数都为2,核外电子层数越多,半径越大,具有相同核外电子排布的离子,核电荷数越大离子半径越小,则离子半径大小顺序为Cl->O2->Na+,故答案为:Cl->O2->Na+;
(2)①Na2O2,为离子化合物,含有过氧键,电子式
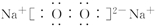 ,故答案为:
,故答案为: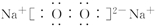 ;
;②S2Cl2的各原子核外电子数都为8电子稳定结构,结构式为Cl-S-S-Cl,故答案为:Cl-S-S-Cl;
③用电子式表示Na2O的形成过程为
 ,故答案为:
,故答案为: ;
;(3)NaOH与CO2反应生成碳酸钠和水,反应中断裂的化学键类型有极性共价键和离子键,故答案为:B、C;
(4)SO2与Cl2通入水中,发生氧化还原反应生成盐酸和硫酸,反应的离子方程式为SO2+Cl2+2H2O=4H++2Cl-+SO42-,
X与S的最高价氧化物的水化物的浓溶液反应的化学方程式为C+2H2SO4(浓)
| ||
故答案为:SO2+Cl2+2H2O=4H++2Cl-+SO42-;C+2H2SO4(浓)
| ||
(5)向由Al、Cl两种元素组成的化合物溶液400mL 1mol/L中加入500mL一定物质的量浓度的NaOH溶液,则可知n(AlCl3)=0.4L×1mol/L=0.4mol,如完全生成沉淀,则应生成0.4molAl(OH)3,得到白色沉淀15.6g,即
| 15.6g |
| 78g/mol |
说明Al3+没有完全生成沉淀,可能存在两种情况:
①NaOH不足,只发生Al3++3OH-=Al(OH)3↓,
0.2mol 0.6mol 0.2mol
此时V(NaOH)=
| 0.6mol |
| 0.5L |
②如NaOH部分过量,先后发生:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,
0.4mol 1.2mol 0.4mol 0.2mol 0.2mol
则V(NaOH)=
| 1.2mol+0.2mol |
| 0.5L |
故答案为:1.2;2.8.
点评:本题考查综合元素周期律、元素周期表、常用化学用语、元素化合物性质、化学方程式的计算等,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意元素及物质的推断是解答本题的关键,注重对高考常考考点的考查,对学生能力要求较高,题目难度中等.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征.其中禁止运动员使用兴奋剂是重要举措之一.如图两种兴奋剂的结构分别为:则关于它们的说法中正确的是( )
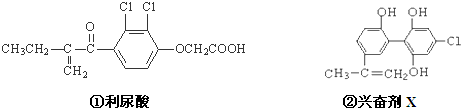
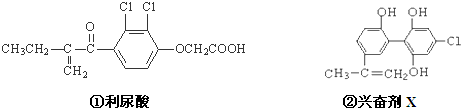
| A、利尿酸乙酯分子中有三种含氧官能团,在核磁共振氢谱上共有七个峰 |
| B、1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、两种兴奋剂最多都能和含3molNaOH的溶液反应 |
| D、两种分子中的所有碳原子均不可能共平面 |
下列说法正确的是( )
| A、增大压强,化学反应速率一定增大 |
| B、化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少 |
| C、升高温度,化学反应速率一定增大 |
| D、加入反应物,化学反应速率增大 |
下列反应中,氯元素被氧化的是( )
A、2KClO3
| ||||
B、2P+5Cl2
| ||||
C、MnO2+4HCl(浓)
| ||||
D、H2+Cl2
|
下列有关能量转换的说法不正确的是( )
| A、煤燃烧主要是化学能转化为光能的过程 |
| B、人类使用照明设备主要是将电能转化为光能 |
| C、动物体内葡萄糖被氧化成CO2是化学能转变成热能的过程 |
| D、化石燃料燃烧时放出的能量均于太阳能 |
能够鉴定氯乙烷中氯元素的存在的操作是( )
| A、在氯乙烷中直接加入AgNO3溶液 |
| B、在氯乙烷中加蒸馏水,然后加入AgNO3溶液 |
| C、在氯乙烷中加入NaOH溶液,加热,冷却后酸化,然后加入AgNO3溶液 |
| D、在氯乙烷中加入乙醇,加热,冷却后酸化,然后加入AgNO3溶液 |
下列反应中,属于加成反应的是( )
| A、CH3Cl+Cl2→CH2Cl2+HCl | |||
| B、CH2=CH2+HO-H→HOCH2-CH3 | |||
C、CH3COOCH2CH3+H2O
| |||
D、 +Br2 +Br2
 +HBr +HBr |
 如图是SO2与O2在接触室中多段催化氧化2SO2(g)+O2(g)?2SO3(g)+Q(Q>0)回答下列问题:
如图是SO2与O2在接触室中多段催化氧化2SO2(g)+O2(g)?2SO3(g)+Q(Q>0)回答下列问题: