题目内容
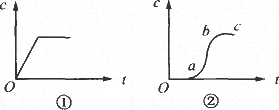
向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始后,溶液中Mn2+的浓度c将随时间t的变化而变化.某学生在做实验前认为,Mn2+的浓度c与时间t的关系如图中①,做完实验后,得到的结果为图中②.请说明下列问题:
(1)写出H2O2与KMnO4反应的化学方程式.
(2)Oa段的意义.
(3)ab段的意义及ab段很陡的原因.
(4)bc段的意义.
答案:
解析:
解析:
|
思路与技巧:应注意观察猜想和实际图象的不同之处和共同之处,当反应结束Mn2+的浓度当然应当保持一定,考虑到Mn2+的催化作用,当Mn2+产生之后,反应速率应当明显加快,表现在图线的斜率上应当变大,因此图①开始的正比例图象不对,图②是实验图象,从图象看一开始应该是反应物浓度最大的时候,单纯考虑浓度反应速率会最大,但催化剂的影响是问题的主要方面,因此Mn2+很少,本身说明反应非常缓慢.当Mn2+量积累到一定程度,反应速率明显加快,但到一定程度,反应物的浓度变的很低,此时速率会变的慢下来,因此斜率变小. |

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.250C时,pH=2的1.0L H2SO4溶液中含有的H+数目为0.02NA |
| B.0.5mol雄黄(,结构如右图)含有NA个S - S键 |
| C.将含有lmolFeCl3溶质的饱和溶液加人沸水中可以得到1 mol Fe(OH)3胶粒 |
| D.向含有FeI2的溶液中通入适蛩氣气,当有1molFe2+被氧化时,该反应转移电子的数目至少为3NA |
