题目内容
9.A、B、C、D、E是中学化学中五种常见元素,有关信息如表:| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,其水溶液能使酚酞变红的原因(用电离方程式解释)为:NH3•H2O?NH4++OH-;
(2)A、D的氢化物相互反应,产生大量白烟,该反应的方程式为:NH3+HCl=NH4Cl;
(3)A与B可组成质量比为7:16的三原子分子,该分子的化学式为NO2.
分析 A、B、C、D、E是中学化学中五种常见元素,A的氢化物水溶液呈碱性,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C的单质须保存在煤油中,则C为Na;D的单质与NaOH溶液反应可用于生产漂白液,则D为Cl;E的单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀,则E为Fe元素,据此解答.
解答 解:A、B、C、D、E是中学化学中五种常见元素,A的氢化物水溶液呈碱性,则A为N元素;B是地壳中含量最多的元素,则B为O元素;C的单质须保存在煤油中,则C为Na;D的单质与NaOH溶液反应可用于生产漂白液,则D为Cl;E的单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀,则E为Fe元素,
(1)A为N元素,氢化物为NH3,其水溶液中一水合氨电离:NH3•H2O?NH4++OH-,溶液呈碱性,能使酚酞变红,
故答案为:NH3;NH3•H2O?NH4++OH-;
(2)A、D的氢化物分别为氨气、HCl,二者相互反应,产生白色固体为NH4Cl,反应方程式为:NH3+HCl=NH4Cl,
故答案为:NH3+HCl=NH4Cl;
(3)N与O可组成质量比为7:16的三原子分子,分子中N原子与氧原子数目之比=$\frac{7}{14}$:$\frac{16}{16}$=1:2,该分子为NO2,
故答案为:NO2.
点评 本题考查结构性质位置关系应用,难度不大,明确元素是解题关键,注意对基础知识的全面掌握.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
17.下列有关化学用语或名称表达正确的是( )
| A. | 聚丙烯的结构简式: | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. |  的名称:3-甲基-1-丁醇 的名称:3-甲基-1-丁醇 |
14.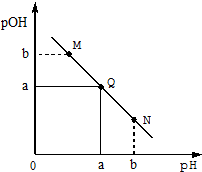 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
说法错误的是( )
 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列说法错误的是( )
| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
19.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂.下列关于氯化亚砜分子的几何构型和中心原子(S)采取杂化方式的说法正确的是( )
| A. | 三角锥形、sp3 | B. | V形、sp2 | C. | 平面三角形、sp2 | D. | 三角锥形、sp2 |
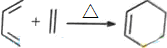 .根据下列转化流程,回答问题:
.根据下列转化流程,回答问题: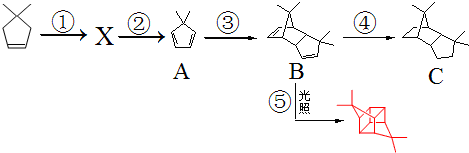
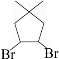 .
.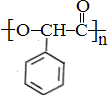 的合成路线:
的合成路线: )
)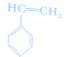 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$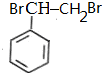 $→_{△}^{NaOH溶液}$
$→_{△}^{NaOH溶液}$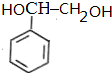 $\stackrel{[O]}{→}$
$\stackrel{[O]}{→}$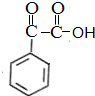 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$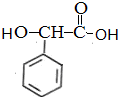 $\stackrel{浓H_{2}SO_{4}△}{→}$
$\stackrel{浓H_{2}SO_{4}△}{→}$

 .
. .
. (其中任一种).
(其中任一种). 结构②苯环上有2个取代基.
结构②苯环上有2个取代基.