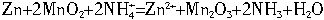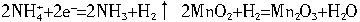题目内容
锌—锰干电池是普遍使用的化学电源,其中含有MnO2、NH4Cl、ZnCl2等的糊状物。以锌筒为负极材料,石墨为正极材料。一节干电池电动势和内电阻分别为W=1.5V,r=0.25W,它对外供电时效率h=75%。干电池的工作原理是:Zn+2MnO![]() +
+![]() =
=![]()
(1)试写出干电池放电时的正、负电极反应式:
正极:_________________________;
负极:_________________________。
干电池用久了就会变软,其原因是_____________________。
(2)正极反应中,前后经历了下列两个反应:
![]() +2e-=2
+2e-=2![]() 如果正极反应没
如果正极反应没
有MnO2的参与,干电池将难于持续稳定工作。试说明理由:_____________。
(3)在通电10min的时间内参加反应的MnO2质量约为________,外电阻消耗的电能是_______________________。
(4)许多国家对废旧电池进行回收,从保护环境和节约能源角度解释为什么要回收废旧电池。_____________________________________________________________。
答案:
解析:
提示:
解析:
| (1)2MnO (2)正极反应中间产物H2附着于石墨,增加电池内阻 (3)0.813g,1.01´103J (4)可以回收到大量的金属材料和化工原料。废旧电池中有害于生态环境的物质在自然条件下极难被降解;废旧锌-锰干电池含有高浓度的氯化铵溶液,埋在土壤中会使土壤酸化,种子脱水死亡
|
提示:
| 提示:依题意:
Q=I×t=1.5A´10´60s=900C。 转移的电子的物质的量为:
=9.34´10-3mol 由电极反应式知:1mole-~1mol MnO2,故消耗MnO2的质量为: 9.34´10-3mol´87g×mol-1=0.813g。 外电阻消耗的电能W=I2Rt=(1.5A)2´0.75W´600s=1.01´103J
|

练习册系列答案
相关题目
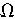 ,对外供电时的效率为?浊=75%。干电池的工作原理是:
,对外供电时的效率为?浊=75%。干电池的工作原理是: