题目内容
【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性甲所示装置可通过观察___,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。
(2)定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为___,实验中需要测量的数据是___。
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应所需时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)写出实验①中H2O2分解的化学方程式___。
(2)通过实验①和②对比可知,化学反应速率与____有关;从实验③和④对比可知,化学反应速率与温度的关系是___。
【答案】反应产生气泡的快慢 控制阴离子相同,消除阴离子不同对实验的干扰 分液漏斗 产生40mL气体所需的时间 2H2O2![]() 2H2O+O2↑ 反应物浓度(或浓度) 温度越高,化学反应速率越快
2H2O+O2↑ 反应物浓度(或浓度) 温度越高,化学反应速率越快
【解析】
I.(1)双氧水分解生成水和氧气,可以根据反应生成气体的快慢来比较催化剂的催化效果;探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件相同,据此分析解答;
(2)定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生40mL的气体所需的时间来比较;
Ⅱ.双氧水分解得到水和氧气;根据表格中的①、②数据和③、④数据的不同点分析解答。
I.(1)双氧水分解生成水和氧气,可以根据反应生成气体的快慢来分析比较Fe3+和Cu2+对H2O2分解的催化效果;在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰,故答案为:反应产生气泡的快慢;控制阴离子相同,消除阴离子不同对实验的干扰;
(2)由图可知,A为分液漏斗;定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生40mL的气体所需的时间来比较,产生40mL的气体所需的时间越短,则催化效果越好,故答案为:分液漏斗;收集40 mL气体所需要的时间;
Ⅱ.(1)双氧水分解得到水和氧气,反应为:2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)从表中分析可知:①②是过氧化氢浓度不同而其他的反应条件均相同,可知这一过程是探究反应物的浓度与反应速率的关系,反应物浓度越大,反应速率越快;实验③④则是温度不同,其他条件相同,探究的是温度对化学反应速率的影响,从结果可知,温度高时反应所用的时间较短,即反应的速率较快,温度低时反应的速率较慢;故答案为:反应物浓度(或浓度);温度越高,化学反应速率越快。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
已知:离子方程式:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
A.①B.②和④C.③和④D.①和②
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
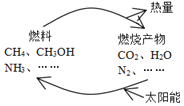
(1)在图构想的物质和能量循环中太阳能最终转化为___能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
用CH3OH、H2O分别表示0~3min内该反应的平均反应速率为___mol/(L·min)-1、____mol/(L·min)-1;
②能说明该反应已达到平衡状态的是___(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),完成并配平通入氧气一极的电极反应式:___。