��Ŀ����
A��B��C��D��X��Y ΪԪ�����ڱ�����������Ԫ�أ���ԭ��������������С��54�������� A2B��Һ̬���ߴ� C���������õİ뵼����ϣ� D��X��Y ԭ��������������Ϊ 7������Ԫ�� Z�� B���γɶ��ֻ�������к���ɫ��ĩ Z2B3��������ɫ�����Ϳ�ϡ�
�밴Ҫ��ش��������⣺
(1����D2��ˮ��Һ����dz��ɫ�� ZD2��Һ�з�����Ӧ�����ӷ���ʽΪ______________��
(2��ѧ������Ϊ X2�� Y2�����ܽ� Z2+����Ϊ Z3+����������������_______________��
(3��ѧ������Ϊ X2�ܽ� Z2+����Ϊ Z3+���� Y2���ܡ�ѧ����������������____________��
(4��A�� B���γɼȺ����Լ��ֺ��Ǽ��Լ��Ļ����� W�� W ��ˮ��Һ�������ԣ�����������Ⱦ������ɱ�����ȡ�
��W �ĵ���ʽΪ___________��W �ĵ�һ�����뷽��ʽΪ____________��
��������� W ��Һ��ˮ�к��� Z3+�������� W ������ɱ����������������ȫʧȥɱ�����á����û�ѧ����ʽ��ʾ��ԭ��________________��
(5��Ǧ(Pb������(Sn������(Ge����Ԫ�� C ͬ���壻�������䵥���ڿ����У��������Ӧ����Ǧ���������һ������Ǧ�����������Ӧ�����������ᷴӦ���ɴ˿ɵó����½��ۣ�
�����ԭ������Ϊ___________��
������+4 ����������ļ�����ǿ������˳��Ϊ_______________(�ѧʽ����
I�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��
��1��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ��ʾ��
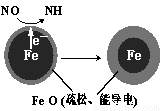
�����ĵ缫��Ӧʽ�� ��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3����ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | �ӽ�100% | ��50% |
24 | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3����ȥ���ʵ͡���ԭ���� ��
��3��ʵ�鷢�֣��ڳ�ʼpH=4.5��ˮ����Ͷ���������۵�ͬʱ������һ������Fe2+�����������NO3����ȥ���ʡ���Fe2+������������ּ��裺
��Fe 2+ֱ�ӻ�ԭNO3������Fe2+�ƻ�FeO��OH�������㡣
2+ֱ�ӻ�ԭNO3������Fe2+�ƻ�FeO��OH�������㡣
�� �Ա�ʵ�飬�����ͼ��ʾ���ɵõ��Ľ����� ��
��ͬλ��ʾ�ٷ�֤ʵFe2+����FeO��OH����Ӧ����Fe3O4����ϸ÷�Ӧ�����ӷ���ʽ�����ͼ���Fe2+���NO3��ȥ���ʵ�ԭ�� ��
II.��������Na2FeO4 ��һ�����;�ˮ����
��4������������Ҫͨ�����·�Ӧ��ȡ:2Fe��OH��3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,��X�Ļ�ѧʽΪ__________��
��5���������ƾ���ǿ�����ԣ���ˮ��Ӧ����Fe��OH��3�����ܹ�����ˮ���������ʣ���д������������ˮ��Ӧ�����ӷ���ʽ ��
����ʵ������ܴﵽʵ��Ŀ�ĵ���
ʵ��Ŀ�� | ʵ����� | |
A | �Ʊ�Fe��OH��3���� | ��NaOHŨ��Һ�μӵ�����FeCl3��Һ�� |
B | ��MgCl2��Һ�Ʊ���ˮgCl2 | ��MgCl2��Һ�������� |
C | ��ȥCu���л��е�CuO | ����ϡ���ᣬ���ˡ�ϴ�ӡ����� |
D | ��CCl4��ȡ��ˮ�е�I2 | �ȴӷ�Һ©���¿ڷų��л��㣬Ȼ����Ͽڵ���ˮ�� |


 СʱpH
СʱpH

 B��CCl4
B��CCl4 
 D��CO2
D��CO2
 ��ʾ������������ȷ����
��ʾ������������ȷ����
 l
l