题目内容
|
有关NaHCO3和Na2CO3的性质,下列叙述错误的是 | |
A. |
等质量的NaHCO3和Na2CO3与足量的盐酸反应,在相同的条件下Na2CO3产生的CO2气体体积大 |
B. |
同一温度下,与等浓度的盐酸反应时,NaHCO3比Na2CO3剧烈 |
C. |
与同种酸反应,生成等量的CO2时,所消耗的酸的量相等 |
D. |
将石灰水加入到NaHCO3溶液中将会产生沉淀 |
答案:AC
解析:
解析:
|
|

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
(2011?福建模拟)已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
|
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)






 +(n-1)H2O
+(n-1)H2O
 或
或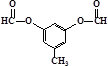
 与G互为同分异构体
与G互为同分异构体