题目内容
在500mL AgNO3溶液中插入惰性电极进行电解,当阴极质量增加54mg时,溶液的pH变化如何?设电解前AgNO3溶液pH=6(电解过程中溶液体积变化忽略不计)。
答案:溶液的pH由电解前的6降低为3。
提示:
提示:
| 阴极:4Ag++4e-=4Ag
阳极:4OH--4e-=2H2O+O2↑ 阴极上增加的Ag的物质的量等于阳极放出的0H-的物质的量。减少的OH-的物质的量也就是溶液中增加的H+的物质的量。 析出Ag即增加的H+的物质的量为:54×10-3/108=5×10-4(mol) 原溶液中H+的物质的量为:500×10-3×10-6=5×10-7(mol) 电解后溶液的c(H+)= pH=-lg10-3=3
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
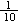 稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。
稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。