题目内容
17.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O3、ClO2、KMnO4氧化性更强,无二次污染.工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.(1)湿法制备高铁酸钾(K2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.
①写出并配平湿法制备高铁酸钾的离子反应方程式:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明了什么问题相同条件下高铁酸钾的溶解度比高铁酸钠的溶解度小
(2)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑.
①该反应中的氧化剂是Na2O2,还原剂是Na2O2、FeSO4,每生成l molNa2FeO4转移5mol电子.
②简要说明K2FeO4作为水处理剂时所起的作用高铁酸钾具有强氧化性,能杀菌消毒,且消毒过程中自身被还原成铁离子,铁离子水解氢氧化铁胶体能吸附除去水中的悬浮杂质.
分析 (1)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,则C1O-作氧化剂被还原生成C1-,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,再结合转移电子守恒配平方程式;
②至饱和可析出高铁酸钾,与溶解度有关;
(2)该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,再结合Na2FeO4和转移电子之间的关系式计算.
解答 解:(1)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,则C1O-作氧化剂被还原生成C1-,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明相同条件下高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:相同条件下高铁酸钾的溶解度比高铁酸钠的溶解度小;
(2)该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,
①得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以Na2O2是氧化剂、Na2O2、FeSO4是还原剂,根据Na2FeO4和转移电子之间的关系式知,每生成l mol Na2FeO4转移电子的物质的量为5mol,
故答案为:Na2O2;Na2O2、FeSO4;5;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质,
故答案为:高铁酸钾具有强氧化性,能杀菌消毒,且消毒过程中自身被还原成铁离子,铁离子水解氢氧化铁胶体能吸附除去水中的悬浮杂质.
点评 本题考查氧化还原反应,为高频考点,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
请回答下列问题(答题时,A、B、C、D、E用所对应元素符号表示):
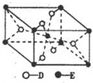
(1)A2D2分子的电子式为
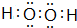 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)A、B、C、D四种元素中电负性大小顺序的是O>N>C>H.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a.M是极性分子,N是非极性分子 b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:
Q(s)+2Cl2(g)═ECl4(l)+D2(g)△H=+140kJ•mol-1
2B(s)+D2(g)═2BD(g)△H=-221kJ•mol-1
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 v(C2)正>v(C2)逆(填写“>”、“=”或“<”)
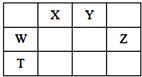 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素的单质不具有半导体的特性,T与Z元素可形成化合物TZ4 |
| A. | 6和8 | B. | 16和12 | C. | 12和9 | D. | 16和8 |
| A. | 氯气 | B. | 过氧化钠 | C. | 氟气 | D. | 金属钾 |
| A. | 与氢氧化钠溶液反应 | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
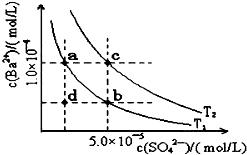 已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )| A. | 温度为T1时,在T1曲线上方区域任意一点时,均有BaSO4沉淀生成 | |
| B. | 蒸发溶剂可能使溶液由d点变为T1曲线上a、b之间的某一点 | |
| C. | 升温可使溶液由b点变为d点 | |
| D. | T2>25℃ |
