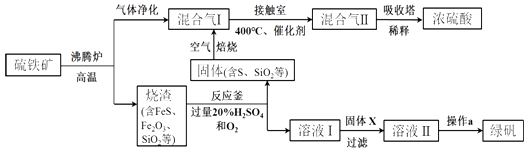
题目内容
【题目】室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是(设NA表示阿伏加德罗常数的值)( ) 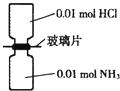
A.反应前气体的总体积为0.448L
B.装置中氢元素的总质量为0.04g
C.生成物中含有0.01NA个分子
D.生成物完全溶于水后所得溶液含有0.01 NA个NH4+
【答案】B
【解析】解:氨气与氯化氢反应:HCl+NH3=NH4Cl,生成0.01mol氯化铵固体. A.常温常压下,气体摩尔体积不是22.4L/mol,大于22.4L/mol,故反应前气体的总体积>(0.01mol+0.01mol)×22.4L/mol=0.448L,故A错误;
B.装置中n(H)=n(HCl)+3n(NH3)=0.01mol+0.01mol×3=0.04mol,故氢元素质量=0.04mol×1g/mol=0.04g,故B正确;
C.生成物为氯化铵,为离子化合物,不存在分子,故C错误;
D.0.01molHCl和0.01molNH3恰好反应,生成的氯化铵为0.01mol,铵根离子是弱碱阳离子,在水溶液中发生水解,加水溶解后所得溶液中NH4+数目小于0.01 NA , 故D错误;
故选B.

 阅读快车系列答案
阅读快车系列答案【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(每次实验所加试剂均过量): 
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体: ①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是(写化学式).
【题目】已知Ca(OH)2、CaCO3和Ca(HCO3)2都是电解质,进行如图所示的实验,请将实验现象填入下表中的空格处。
实验操作 | 灯泡亮度变化 |
①通入CO2之前 | 亮 |
②开始通入CO2时 | |
③恰好完全沉淀 | |
④沉淀完全后,继续通入过量CO2 | |
⑤再通入CO2 |