题目内容
在400K时,向有机物A的蒸气20mL中充入60mL氧气,引燃恰好完全反应,产生的CO2和H2O(气)的体积比为2∶3,冷却到反应前状态时,混合气体的密度比反应前减少1/5,试通过计算确定该有机物的分子式.
答案:
解析:
解析:
|
解:∵ ∴ 由耗氧量关系有:n+3n/4-m/2=60/20,即7n-2m=12 ① 又∵反应前后密度与体积成反比,即:ρ1/ρ2=V2/V1=ρ1/(ρ1-1/5ρ1)=5/4; ∴V2=(5/4)×V1=(5/4)×(20+60)=100(mL); ∴体积差ΔV=100-80=20(mL).由燃烧反应式: CnH3nOm+(7n/4-m/2)O2→nCO2+3n/2H2O…ΔV=(3n/4+m/2-1) 1ml (3n/4+m/2-1)mL 20mL 20mL ∴有3n/4+m/2-1=1 即:3n+2m=8 ② 联解①②两式得:n=2,m=1.∴该有机物的分子式为:C2H6O 解法(二):∵有机物nC∶nH=2∶3×2=1∶3,可设该有机物分子式为CnH3nOm 又∵n有机∶ 由氧守恒得:m+6=2n+ 讨论:当n=1,m=-2.5;n≥3均不合理.只有n=2,m=1合理. ∴该有机物为C2H6O. |

练习册系列答案
相关题目
 ∶
∶ =2∶3
=2∶3 ∶
∶ =2∶3有机物中的C与H个数比为1∶3,∴设有机物分子式为:CnH3nOm
=2∶3有机物中的C与H个数比为1∶3,∴设有机物分子式为:CnH3nOm =20∶60=1∶3则:CnH3nOm+3O2→nCO2+
=20∶60=1∶3则:CnH3nOm+3O2→nCO2+ H2O
H2O ,得7n-2m=12
,得7n-2m=12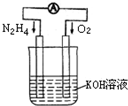 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.