题目内容
下列说法不正确的是( )
| A、Y和Z均由元素R组成,反应Y+2I-+2H+=I2+Z+H2O,其中的R元素在地壳中含量位居第一 |
| B、F2、C2H4、Na2O2、C2H6、H2O2都是含有非极性键的共价化合物 |
| C、锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+Li=LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-=V2O5+xLi+ |
| D、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
考点:共价键的形成及共价键的主要类型,氧化还原反应,电极反应和电池反应方程式,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、由反应Y+2I-+2H+=I2+Z+H2O,根据质量守恒可知,Y含有氧元素,Y和Z均由元素R组成,所以R为氧元素;
B、过氧化钠为离子化合物;
C、放电为原电池,充电为电解池,依据电解池阳极发生氧化反应回答;
D、依据盐类水解原理解答.
B、过氧化钠为离子化合物;
C、放电为原电池,充电为电解池,依据电解池阳极发生氧化反应回答;
D、依据盐类水解原理解答.
解答:
解:A、由反应Y+2I-+2H+=I2+Z+H2O,根据质量守恒可知,Y含有氧元素,Y和Z均由元素R组成,所以R为氧元素,故A正确;
B、Na2O2是含有非极性共价键的离子化合物,故B错误;
C、锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+Li=LixV2O5.供电(放电)时Li+向正极移动,正确,充电(电解)时阳极发生失去电子的氧化反应,即阳极的电极反应式为:LixV2O5-xe-=V2O5+xLi+,故C正确;
D、Mg(OH)2能溶于水存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),故加入NH4+结合OH-使沉淀溶解平衡向右移动,故D正确,故选B.
B、Na2O2是含有非极性共价键的离子化合物,故B错误;
C、锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+Li=LixV2O5.供电(放电)时Li+向正极移动,正确,充电(电解)时阳极发生失去电子的氧化反应,即阳极的电极反应式为:LixV2O5-xe-=V2O5+xLi+,故C正确;
D、Mg(OH)2能溶于水存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),故加入NH4+结合OH-使沉淀溶解平衡向右移动,故D正确,故选B.
点评:本题主要考查的是质量守恒的应用、共价化合物和离子化合物的判断、电解原理等,属于常考题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有机反应中,能够实现的是( )
A、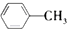 +Cl2 +Cl2
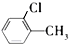 +HCl +HCl | |||
B、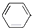 +CH2═CH-CH3 +CH2═CH-CH3
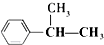 | |||
C、ClCH2CH2CH3+NaOH
| |||
D、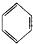 +2HONO2 +2HONO2
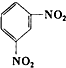 +2H2O +2H2O |
下列反应中,反应物总能量低于生成物总能量的是(( )
| A、C+CO2=2CO |
| B、C+O2=CO2 |
| C、2C+O2=2CO |
| D、C+CuO=CO2+Cu |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、28g氮气含有NA个原子 |
| B、标准状况下,22.4LH2O含有NA个H2O分子 |
| C、1mol/L的硝酸钠溶液中含有的硝酸根离子数为NA |
| D、甲烷的摩尔质量与NA个甲烷分子的质量在数值上相等 |
下列关于氯化铁溶液与氢氧化铁胶体不正确的是( )
| A、将把1毫升饱和三氯化铁溶液逐滴加入20毫升沸水中(边加边振荡)并继续加热至沸,即可得到氢氧化铁胶体 |
| B、加热蒸干、灼烧后都有氧化铁生成 |
| C、二者都呈红褐色,可利用丁达尔效应鉴别 |
| D、将H2SO4溶液逐滴加入Fe(OH)3胶体内,开始时产生沉淀,继续滴加时沉淀又溶解 |
以下各组离子能在给定的四种溶液中大量共存的是( )
| A、加入铁粉产生大量气体的溶液:Cu2+、Na+、Mg2+、NO3- |
| B、滴加酚酞显红色的溶液:Fe3+、NH4+、Cl-、NO3- |
| C、无色透明溶液:K+、SO42-、NO3-、OH- |
| D、碱性溶液:K+、HCO3-、Cl-、Ba2+ |
X2气和Y2气共100mL,一定条件下使它们充分反应,恢复到原状况时,发现体积仍是100mL,这说明( )
| A、X2气过量 |
| B、X2气Y2气各50mL |
| C、产物是双原子分子 |
| D、无法作出上述判断 |