题目内容
2.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)??CH3OH(g)达到化学平衡状态.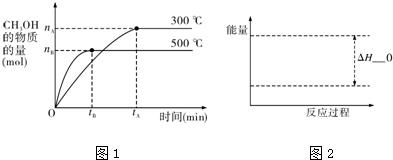
(1)判断该可逆反应达到化学平衡状态的标志是a、c(填字母).
a.CO、H2、CH3OH的浓度均不再变化
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.v生成(CH3OH)=v消耗(CO)
(2)300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是c、d(填字母).
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
(3)根据题目有关信息,请在下面坐标图1,2中标示出该化学反应过程的能量变化(标明信息).
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,反应速率增大,平衡向正反应方向移动,以此判断;
(3)根据该反应放热,生成物的总能量小于反应物的总能量,△H<O;
解答 解:(1)a、平衡时各物质的浓度保持不变,CH3OH、H2O、CO2、H2的浓度都不再发生变化,说明到达平衡,故a正确;
b、容器的体积不变,混合气体的质量不变,混合气体的密度始终不变,混合气体密度不变,不能说明到达平衡,故b错误;
c、混合气体的质量不变,混合气体的物质的量增大,随反应进行平均相对分子质量减小,混合气体的平均相对分子质量不变,说明到达平衡,故c正确;
d、v生成(CH3OH)=v消耗(CO)都表示正反应速率,自始至终都按1:1进行,不能说明到达平衡,故d错误.
故答案为:a、c;
(2)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,浓度增大,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,浓度增大,故有$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$=$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小,
故答案为:c、d;
(3)该反应放热,生成物的总能量小于反应物的总能量,△H<O,图象为: ;
;
故答案为: .
.
点评 本题主要考查化学反应速率、平衡的移动、平衡状态的判断等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
13.保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是( )
| A. | 蒸发溶剂 | B. | 升高温度 | C. | 降低温度 | D. | 加入KN03固体 |
10.某温度下,关于①0.01mol/L 醋酸溶液,②pH=2的醋酸溶液,下列说法正确的是( )
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
7.2.16g X2O5中含有0.1mol氧原子,则X的摩尔质量为( )
| A. | 28 | B. | 28 g•mol-1 | C. | 14 | D. | 14 g•mol-1 |
12.表是有机物A、B的有关信息.
根据表中信息回答下列问题:
(1)A的名称是:乙烯
(2)写出在一定条件下,A生成高分子化合物的化学反应方程式 .
.
(3)B的名称为:苯.B与乙苯互为同系物.其中乙苯的同分异构体还3 种.写出其中一种的物质名称邻二甲苯(或间二甲苯或对二甲苯).
| A | B |
| ②使溴的四氯化碳溶液褪色; ②比例模型为: 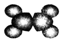 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 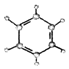 |
(1)A的名称是:乙烯
(2)写出在一定条件下,A生成高分子化合物的化学反应方程式
 .
.(3)B的名称为:苯.B与乙苯互为同系物.其中乙苯的同分异构体还3 种.写出其中一种的物质名称邻二甲苯(或间二甲苯或对二甲苯).
 回答下列问题:
回答下列问题: