题目内容
10.AgCl悬浊液中存在溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向适量AgCl悬浊液中加入足量1mol/L的HI溶液,振荡后,大部分AgCl转化成了AgI,该反应过程说明( )| A. | I-的还原性比Cl-强 | B. | AgI的溶解度比AgCl的溶解度大 | ||
| C. | 氢碘酸、盐酸均为强酸 | D. | AgI比AgCl更难溶 |
分析 向适量AgCl悬浊液中加入足量1mol/L的HI溶液,振荡后,大部分AgCl转化成了AgI,说明AgI比AgCl更难溶,实现了沉淀的转化,则AgI的溶解度比AgCl的溶解度小,而与酸性强弱、还原性强弱无关,据此进行判断.
解答 解:AgCl悬浊液中存在溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),向适量AgCl悬浊液中加入足量1mol/L的HI溶液,振荡后,大部分AgCl转化成了AgI,说明AgI比AgCl更难溶,实现了沉淀的转化,则AgI的溶解度比AgCl的溶解度小,
A.该反应不是氧化后还原反应,无法据此判断离子的还原性强弱,故A错误;
B.说明了碘化银的溶解度比氯化银的溶解度小,实现了沉淀的转化,故B错误;
C.只是发生了沉淀的转化,无法判断氢碘酸、盐酸的酸性强弱,故C错误;
D.大部分AgCl转化成了AgI,证明AgI比AgCl更难溶,发生了沉淀的转化,故D正确;
故选D.
点评 本题考查了难溶物溶解平衡及沉淀转化的实质,题目难度中等,掌握溶解平衡的影响因素及沉淀转化的实质为解答关键,需要明确溶解度越小,越容易生成沉淀.

练习册系列答案
相关题目
1.BF3与一定量水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R: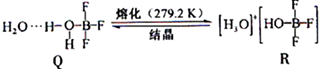
晶体Q中各种微粒间的作用力不涉及( )
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力.

晶体Q中各种微粒间的作用力不涉及( )
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力.
| A. | abd | B. | ad | C. | acd | D. | bd |
5.Na2O2、CaC2、CaH2、FeS2均为离子化合物,前三种物质极易与水反应下列有关叙述中正确的是( )
| A. | 1molNa2O2与水反应转移2mol电子 | |
| B. | CaH2在水中以Ca2+和H-离子形式存在 | |
| C. | 四种化合物晶体类型和化学键类型均相同 | |
| D. | FeS2阴离子电子式为 |
15.用石墨作电极电解CuSO4溶液.通电一段时间后,两电极都产生了气泡,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
| A. | CuSO4 | B. | H2O | C. | CuO | D. | Cu(OH)2 |
2.可逆反应A(g)+3B(g)?2C(g)(正反应为放热反应)处于平衡状态,下列条件中可以提高A 的转化率的是:①高温②低温③高压④低压⑤加催化剂⑥除去C⑦增加A ⑧增加B( )
| A. | ①③⑤⑦ | B. | ②④⑥⑧ | C. | ②③⑥⑧ | D. | ②④⑤⑦ |
20.都能用氢氧化钠溶液进行喷泉实验的一组气体是( )
| A. | HCl和CO2 | B. | NH3和CO | C. | SO2和CO | D. | NO2和NO |