题目内容
在常温下,铁在干燥的空气中很难生锈.但在潮湿的空气中,铁很容易发生吸氧腐蚀生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.铁生锈的化学原理如下,请你用离子方程式、电极反应式和化学方程式补充完整.
(1)原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
(2)氢氧化物的形成: 、 .
(3)氢氧化物的分解:2Fe(OH)3=Fe2O3+3H2O.
(1)原电池反应:
负极:2Fe-4e-=2Fe2+、正极:
(2)氢氧化物的形成:
(3)氢氧化物的分解:2Fe(OH)3=Fe2O3+3H2O.
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:金属铁在潮湿的空气下发生吸氧腐蚀,铁做负极发生氧化反应生成二价铁离子,碳等杂志做负极,氧气在负极得到电子发生还原生成氢氧根离子,根据原电池原理来书写电极反应和总反应,氢氧化亚铁具有强的还原性,被氧化生成氢氧化铁,据此解答.
解答:
解:金属铁在潮湿的空气下发生吸氧腐蚀,铁做负极发生氧化反应生成二价铁离子,电极反应式:2Fe-4e-=2Fe2+;碳等杂志做负极,氧气在负极得到电子发生还原生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-;原电池总反应方程式为:Fe2++2OH-=Fe(OH)2;氢氧化亚铁具有强的还原性,被氧化生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:(1)O2+4e-+2H2O=4OH-;
(2)Fe2++2OH-=Fe(OH) 2;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:(1)O2+4e-+2H2O=4OH-;
(2)Fe2++2OH-=Fe(OH) 2;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查了金属的腐蚀与防护,题目难度不大,明确原电池工作原理,熟悉吸氧腐蚀和析氢腐蚀的区别是解题关键,题目难度不大.

练习册系列答案
相关题目
莽草酸可用于合成药物达菲,其结构简式如图所示,下列关于莽草酸的说法正确的( )
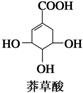

| A、能使FeCl3溶液显色 |
| B、分子中含有2种官能团 |
| C、可发生加成和取代反应 |
| D、分子中所有原子可以共平面 |
下列金属冶炼的反应原理错误的是( )
A、2AlCl3(熔融)
| ||
B、CuO+H2
| ||
C、Fe3O4+4CO
| ||
D、2HgO
|
下列分子式只表示一种纯净物的是( )
| A、C2H6O |
| B、C3H8 |
| C、C4H10 |
| D、C |
下列金属中,能与氯气和盐酸反应,且两反应生成相同氯化物的是( )
| A、Fe | B、Al | C、Cu | D、Ag |
同温同压下,等体积的N2和NH3,具有相同的( )
| A、密度 | B、分子数 |
| C、氮原子数 | D、质量 |