题目内容
16.有机化合物香醇可以用作食用香精,其结构如图所示: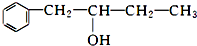
(1)香醇的分子式为C10H14O;它可能发生的有机反应类型是①②③⑤.(填序号)
①取代反应 ②加成反应 ③消去反应 ④聚合反应 ⑤氧化反应 ⑥水解反应
(2)有机物丙(C13H18O2)是一种香料,其合成路线如图所示,其中甲的相对分子质量为88,它的核磁共振氢谱显示有3组峰,乙为香醇的同系物.
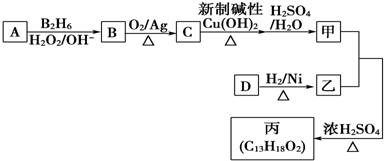
已知:R-CH=CH2$→_{H_{2}O_{2}/OH-}^{B_{2}H_{6}}$ R-CH2CH2OH.
①A的名称2-甲基丙烯;
②C与新制碱性Cu(OH)2反应的化学方程式(CH3)2CHCHO+2Cu(OH)2 $\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O
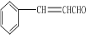
③丙中有两个甲基,在一定条件下,1mol D可以和2mol H2反应生成乙(苯环不加氢),D可以发生银镜反应,则D的结构简式为
 ;
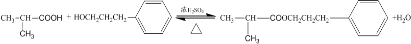
;④甲与乙反应的化学方程式为
 ;
;⑤甲的同分异构体中含有“酯基”结构的共有4种.
分析 (1)根据香醇的结构简式书写其分子式;由结构可知,可以醇羟基,具有醇的性质,含有苯环,具有苯的性质,为C6H5CH(OH)CH3,据此分析其性质;
(2)A发生信息反应生成B,B连续氧化、酸化得到甲,则甲为羧酸,相对分子质量为88,减去1个-COOH后剩余基团的式量=88-45-43,为-C3H7,它的核磁共振氢谱显示只有三组峰,则甲为2-甲基丙酸,结合转化关系可知,A为2-甲基丙烯,结构简式为CH2=C(CH3)2,B为2-甲基-1-丙醇,结构简式为(CH3)2CHCH2OH,C为2-甲基丙醛,结构简式为:(CH3)2CHCHO,甲与乙反应酯化生成丙(C13H18O2),则乙为C9H12O,丙中有两个甲基,则乙中不含甲基,乙为香醇的同系物,则乙的结构简式为 ,由1molD与2mol氢气反应生成乙,所以D为C9H8O,可以发生银镜反应,含有-CHO,故D为
,由1molD与2mol氢气反应生成乙,所以D为C9H8O,可以发生银镜反应,含有-CHO,故D为 ,然后结合物质的结构与性质来解答.
,然后结合物质的结构与性质来解答.
解答 解:(1)由香醇的结构可知,其分子式为C10H14O,含有醇羟基,可以发生氧化、取代、消去反应,含有苯环,含有发生加成反应,不能发生水解、聚合反应,
故答案为:C10H14O;①②③⑤;
(2)A发生信息反应生成B,B连续氧化、酸化得到甲,则甲为羧酸,相对分子质量为88,减去1个-COOH后剩余基团的式量=88-45-43,为-C3H7,它的核磁共振氢谱显示只有三组峰,则甲为2-甲基丙酸,结合转化关系可知,A为2-甲基丙烯,结构简式为CH2=C(CH3)2,B为2-甲基-1-丙醇,结构简式为(CH3)2CHCH2OH,C为2-甲基丙醛,结构简式为:(CH3)2CHCHO.甲与乙反应酯化生成丙(C13H18O2),则乙为C9H12O,丙中有两个甲基,则乙中不含甲基,乙为香醇的同系物,则乙的结构简式为 ,由1molD与2mol氢气反应生成乙,所以D为C9H8O,可以发生银镜反应,含有-CHO,故D为
,由1molD与2mol氢气反应生成乙,所以D为C9H8O,可以发生银镜反应,含有-CHO,故D为 ,
,
①由上述分析可知,A为2-甲基丙烯,故答案为:2-甲基丙烯;
②C与新制Cu(OH)2悬浊液反应的化学方程式为(CH3)2CHCHO+2Cu(OH)2 $\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O,
故答案为:(CH3)2CHCHO+2Cu(OH)2 $\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O;
③由上述分析可知,D的结构简式为 ,故答案为:
,故答案为: ;
;
④甲与乙反应的化学方程式为 ,
,
故答案为: ;
;
⑤甲为2-甲基丙酸,甲的同分异构体中属于酯的结构,
构成酯的酸、与醇有以下情况:
酸为丙酸、醇为甲醇,有1种,
酸为乙酸、醇为乙醇,有1种,
酸为甲酸、醇为丙醇,丙醇有2种,故形成的酯有2种,
故符合条件的甲的同分异构体有4种,
故答案为:4.
点评 本题考查有机物的推断与合成,需要学生对给予的信息进行利用,能较好的考查学生的阅读能力、自学能力,是热点题型,根据反应信息结合B连续氧化生成甲判断甲为羧酸,再结合甲的相对分子质量利用残余法确定其结构是解题的关键,题目难度较大,综合性较强.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式
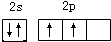 ;
;写出甲醇分子中官能团的电子式
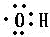 .
.(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
| A. | 氢氧根离子的电子式: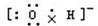 | B. | NH4Br的电子式: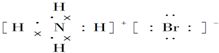 | ||
| C. | 四氯化碳的电子式: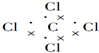 | D. | H2O的结构式:H-O-H |
| A. | 苯酚中滴加少量的稀溴水出现了1-溴苯酚的白色沉淀 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丁烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
| A. | 浓硫酸可做为H2、NH3等气体的干燥剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 足量的锌与一定量的浓硫酸反应会生成氢气 | |
| D. | 可用铝罐储运热的浓硫酸、浓硝酸 |
族 周期 | ⅠA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是F(填元素符号),其离子结构示意图为
 .
.(2)写出②的氢化物的电子式:
 ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.(3)最高价氧化物对应的水化物中碱性最强的是NaOH,写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)写出由③⑤⑩三种元素组成、且暴露空气中易变质的化合物化学式:Na2SO3;该化合物含有化学键类型有:离子键、共价键;写出该物质暴露空气中变质的化学方程式:2Na2SO3+O2=2Na2SO4.
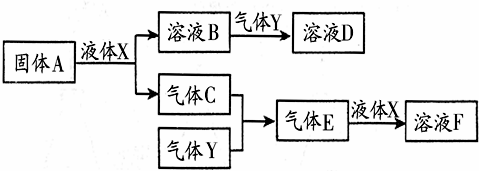
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生如图中的变化,其中A是一种淡黄色固体,可作供氧剂.X是一种氢化物,常温下为液体.则:
(1)写出A的晶体中存在的作用力有:共价键、离子键;
(2)气体Y是一种大气污染物,无色、有刺激性气味的,直接排放会形成酸雨.写出气体C与气体Y反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3;
(3)在100mL 18mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2L(标况下),则反应过程中转移的电子数为NA 或6.02×1023.
| A. | 15 g甲基所含有的电子数是NA | |
| B. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA | |
| D. | 常温常压下,1 mol丙烷所含有的共价键数目为12NA |
| A. | 甲苯 | B. | 乙烯 | C. | 环己烷 | D. | 聚苯乙烯 |