题目内容
16.如图1为长式周期表的一部分,其中的编号代表对应的元素.
(1)比较①和②具有相同核外电子排布的简单离子半径大小关系为H->Li+(填化学式);③、④、⑤三种元素的第一电离能由大到小的顺序为N>O>C(填元素符号),写出原子序数和元素⑧相差2且与元素⑧同族的元素基态原子的外围电子排布式3d84s2.
(2)在元素③与①形成的原子个数比为1:1的四原子分子中,③原子的杂化方式为sp.其分子中δ键和π键数目之比为3:2.
(3)元素④的某种氢化物甲分子中含有18个电子,甲为二元弱碱,在水中的电离方程式与氨相似.写出甲在水中的第一步电离的电离方程式N2H4+H2O?N2H5++OH-.甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,其化学方程式为N2H4+2H2O2=N2+4H2O.
(4)元素⑥和⑤形成分子乙的结构与元素①和⑤形成的最简单分子丙相似,乙的VSEPR模型为四面体,解释丙的沸点高于乙的原因OF2和H2O均由分子构成,H2O分子间可形成氢键,使分子间作用强于OF2分子间的范德华力.
(5)可用赤血盐K3[Fe(CN)6]检验元素⑧的+2价阳离子,写出该反应的离子方程式3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,元素⑩的阴离子与元素⑧的+2价离子形成化合物丁,将3molCl2通入含4mol丁的溶液,用一个离子方程式表示该反应过程为3Cl2+4Fe2++2Br-=4Fe3++Br2+6Cl-.
(6)晶胞有两个基本要素:
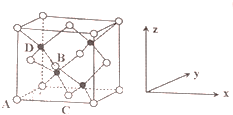
①原子坐标参数,表示晶胞内部各原子的相对位置,如图2为⑦和⑨组成的离子化合物戊的晶胞,其中三个离子(白色球)坐标参数A为(0,0,0);B为($\frac{1}{2}$,0,$\frac{1}{2}$);C为($\frac{1}{2}$,$\frac{1}{2}$,0).则D离子(黑色球)的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{3}{4}$).
②晶胞参数,描述晶胞的大小和形状,已知戊的晶胞参数apm,则晶胞中B和D离子的距离为$\frac{\sqrt{3}a}{4}$pm.
分析 由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为S、⑧为Fe、⑨为Zn、⑩为Br.
(1)电子层结构相同的离子,核电荷数越大离子半径越小;
同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
原子序数和元素⑧相差2且与元素⑧同族的元素为Ni;
(2)元素③与①形成的原子个数比为1:1的四原子分子为H-C≡C-H;
(3)元素④的某种氢化物甲分子中含有18个电子,则甲为N2H4,甲为二元弱碱,在水中的电离方程式与氨相似,甲在水中的第一步电离生成N2H5+、OH-;
甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,即反应生成氮气与水;
(4)元素①和⑤形成的最简单分子丙为H2O,元素⑥和⑤形成分子乙的结构与H2O的结构相似,则乙为O2F,水分子之间形成氢键,沸点较高;
(5)K3[Fe(CN)6]检验元素⑧的+2价阳离子,反应生成Fe3[Fe(CN)6]2蓝色沉淀,
元素⑩的阴离子与元素⑧的+2价离子形成化合物丁为FeBr2,氯气先氧化亚铁离子,后氧化溴离子,根据电子转移守恒计算参加反应亚铁离子、溴离子物质的量,再配平书写离子方程式;
(6)D与周围4个原子形成正四面体结构,D与晶胞顶点的连线处于晶胞体对角线上,且D与晶胞顶点距离为晶胞体对角线长度的$\frac{1}{4}$.
解答 解:由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为S、⑧为Fe、⑨为Zn、⑩为Br.
(1)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:H->Li+,
同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C;
原子序数和元素⑧相差2且与元素⑧同族的元素为Ni,其外围电子排布式为:3d84s2,
故答案为:H->Li+;N>O>C; 3d84s2;
(2)元素③与①形成的原子个数比为1:1的四原子分子为H-C≡C-H,碳原子的杂化方式为sp,其分子中δ键和π键数目之比为3:2,
故答案为:sp;3:2;
(3)元素④的某种氢化物甲分子中含有18个电子,则甲为N2H4,甲为二元弱碱,在水中的电离方程式与氨相似,甲在水中的第一步电离生成N2H5+、OH-,第一步电离方程式为:N2H4+H2O?N2H5++OH-,
甲在微电子工业中,可作刻蚀剂H2O2的清除剂,二者发生反应的产物不污染环境,即反应生成氮气与水,化学反应方程式为:N2H4+2H2O2=N2+4H2O,
故答案为:N2H4+H2O?N2H5++OH-;N2H4+2H2O2=N2+4H2O;
(4)元素①和⑤形成的最简单分子丙为H2O,元素⑥和⑤形成分子乙的结构与H2O的结构相似,则乙为O2F,是分子中O原子价层电子对数=2+$\frac{6-1×2}{2}$=4,VSEPR模型为四面体,故O2F的VSEPR模型为四面体,
OF2和H2O均由分子构成,H2O分子间可形成氢键,使分子间作用强于OF2分子间的范德华力,水的沸点较高,
故答案为:四面体;OF2和H2O均由分子构成,H2O分子间可形成氢键,使分子间作用强于OF2分子间的范德华力;
(5)K3[Fe(CN)6]检验元素⑧的+2价阳离子,反应生成Fe3[Fe(CN)6]2蓝色沉淀,反应离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,
元素⑩的阴离子与元素⑧的+2价离子形成化合物丁为FeBr2,氯气先氧化亚铁离子,后氧化溴离子,
4molFe2+反应消耗Cl2为$\frac{4mol×1}{2}$=2mol,剩余1molCl2,可以氧化Br-为2mol,用一个离子方程式表示该反应过程为:3Cl2+4Fe2++2Br-=4Fe3++Br2+6Cl-,
故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;3Cl2+4Fe2++2Br-=4Fe3++Br2+6Cl-;
(6)①D与周围4个原子形成正四面体结构,D与晶胞顶点的连线处于晶胞体对角线上,且D与晶胞顶点距离为晶胞体对角线长度的$\frac{1}{4}$,故D原子的x=$\frac{1}{4}$、y=$\frac{1}{4}$、z=$\frac{3}{4}$,则D原子的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{3}{4}$),
故答案为:($\frac{1}{4}$,$\frac{1}{4}$,$\frac{3}{4}$);$\frac{1}{4}$×
②戊的晶胞参数为apm,则晶胞体对角线长度为$\sqrt{3}$a pm,故晶胞中B和D离子的距离为$\frac{1}{4}$×$\sqrt{3}$a pm=$\frac{\sqrt{3}a}{4}$ pm,
故答案为:$\frac{\sqrt{3}a}{4}$.
点评 本题是对物质结构与性质的考查,涉及元素周期表、微粒半径比较、杂化方式判断、配合物、氧化还原反应、晶胞计算等,(6)中晶胞计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度较大.

| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ba(HCO3)2与澄清石灰水反应 | ||
| C. | Ca(HCO3)2与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
| A. |  1,4-二甲基丁烷 | B. |  3-甲基丁烯 | C. |  2-甲基丁烷 | D. |  二甲苯 |
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌
D.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
E.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,观察
F.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
(2)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处.
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |

 ,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).
,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).