题目内容
4.标出下列氧化还原反应电子转移数目方向,并写出氧化剂和还原剂.(1)2MnO2+4KOH+O2=2K2MnO4+2H2O氧化剂是O2,还原剂是MnO2.
(2)3NaClO3+10HCl(浓)=3NaCl+4Cl2↑+2ClO2↑+5H2O还原剂是HCl,氧化剂是NaClO3.
分析 (1)2MnO2+4KOH+O2=2K2MnO4+2H2O反应中Mn的化合价升高,O元素的化合价降低;
(2)3NaClO3+10HCl(浓)=3NaCl+4Cl2↑+2ClO2↑+5H2O反应NaClO3中Cl元素的化合价降低,HCl中Cl元素的化合价升高,结合氧化还原反应的概念分析.
解答 解:(1)2MnO2+4KOH+O2=2K2MnO4+2H2O反应中Mn的化合价升高,则MnO2被氧化,MnO2作还原剂,O元素的化合价降低,则O2被还原,O2作氧化剂,反应中转移4个电子,则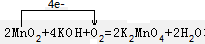 ;
;
故答案为:O2;MnO2;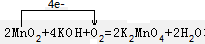 ;
;
(2)3NaClO3+10HCl(浓)=3NaCl+4Cl2↑+2ClO2↑+5H2O反应NaClO3中Cl元素的化合价降低,被还原,则NaClO3为还原剂,HCl中Cl元素的化合价升高,被氧化,则HCl为还原剂,反应中转移电子数为7,则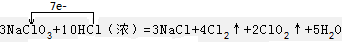 ;
;
故答案为:HCl;NaClO3; .
.
点评 本题考查氧化还原反应,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
14.下列各组物质间不能发生反应的是( )
| A. | 铁与稀硝酸 | B. | 铁和硫酸铜溶液 | ||
| C. | 铁和氢氧化钠溶液 | D. | 铁粉与灼热的水蒸气 |
15.下列离子方程式正确的是( )
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
12.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
19.将400mL0.3mol/L的FeSO4溶液加入到100mL K2Cr2O7熔液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为( )
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
16.某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4•5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是Fe2O3、SiO2(填化学式)
(2)写出过程②发生反应的离子方程式:SiO2+2OH-═SiO32-+H2O.
过程Ⅱ:

(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(化为最简整数比)
过程Ⅲ:已知25℃时:
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2 溶液,调节溶液的pH范围为4.0≤pH<5.4,然后过滤、结晶,可得CuSO4•5H2O.
(5)下列与Ⅲ方案 相关的叙述中,正确的是ACD填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在.
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是Fe2O3、SiO2(填化学式)
(2)写出过程②发生反应的离子方程式:SiO2+2OH-═SiO32-+H2O.
过程Ⅱ:

(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(5)下列与Ⅲ方案 相关的叙述中,正确的是ACD填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在.
3.下列各组溶液,不需要其他试剂就可以鉴别出来的是( )
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.