题目内容
18.用焰色反应检验K+时的操作步骤有:①蘸取待测液
②置于酒精灯火焰上灼烧
③透过蓝色钴玻璃观察
④用稀盐酸洗净铂丝.
其中正确的操作顺序为( )
| A. | ①②③④ | B. | ④②①②③ | C. | ④①② | D. | ①③②④ |
分析 根据焰色反应的操作步骤为:洗、烧、取、烧、观察来分析解答.
解答 解:焰色反应的操作步骤:④用稀盐酸洗净铂丝,②置酒精灯火焰上灼烧,①蘸取待测液,②置酒精灯火焰上灼烧,③透过蓝色钴玻璃观察火焰颜色,即顺序为④②①②③,故选B.
点评 本题考查焰色反应的操作步骤,难度适中,考查学生解决实际问题的能力.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
8.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图,且方法②的反应只能在高温下发生,则方法②中反应的△H=a+3b-c kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) $?_{催化剂}^{高温、高压}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol•L-1•min-1(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol•L-1,则NH3•H2O的电离平衡常数K=1.80×10-5mol•L-1(保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
电池正极的电极反应式是N2+6e-+8H+=2NH4+,A是NH4Cl.
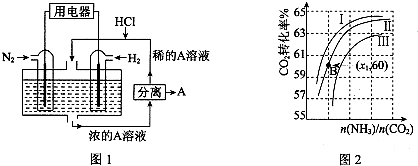
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图,且方法②的反应只能在高温下发生,则方法②中反应的△H=a+3b-c kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) $?_{催化剂}^{高温、高压}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol•L-1•min-1(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol•L-1,则NH3•H2O的电离平衡常数K=1.80×10-5mol•L-1(保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
电池正极的电极反应式是N2+6e-+8H+=2NH4+,A是NH4Cl.

(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.
9.下列反应中,光照对反应几乎没有影响的是( )
| A. | 次氯酸分解 | B. | 甲烷与氯气反应 | C. | 甲烷与氧气反应 | D. | 氯气与氢气反应 |
13.将一小块金属钠投入一无色水溶液中,既能生成气体,又能生成沉淀的是( )
| A. | CuCl2 | B. | FeCl3 | C. | MgSO4 | D. | BaCl2 |
3.下列关于苯酚的叙述正确的为( )
| A. | 苯酚呈弱酸性,能够使石蕊试液显红色 | |
| B. | 提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| C. | 苯酚能够与氯化铁溶液反应生成紫色沉淀 | |
| D. | 苯酚分子中的13个原子可能处于同一平面上 |
10.在2L密闭容器中,一定条件下发生反应A+3B?2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A. | 0.08mol/(L•s) | B. | 0.02mol/(L•s) | C. | 0.4mol/(L•s) | D. | 0.2mol/(L•s) |
7.下列物质在水溶液中,存在电离平衡的是( )
| A. | HBr | B. | CH3COOH | C. | BaSO4 | D. | CH3COONa |