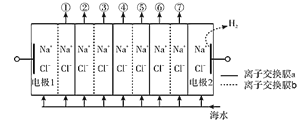
题目内容
【题目】据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为__________,原子核外有__________个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是__________;H2O的VSEPR模型为______________。
(Ⅱ)Na2CO3中存在的作用力类型主要有__________,CO32-中C的杂化类型为___________。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
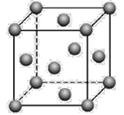
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏加德罗常数为NA。则晶体中金原子的配位数为_______,金原子(或粒子)的半径r=___pm(用含ρ和NA的代数式表示)。
【答案】6s26p2 2 Zn的价电子排布式为3d104s2,全充满结构稳定,而Ga的价电子排布式为4s24p1,不稳定,所以锌的第一电离能大于镓的第一电离能 离子晶体 四面体形 离子键、共价键 sp2 ![]() 1:1 12
1:1 12 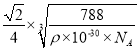
【解析】
(1)铅原子位于第六周期第ⅣA族,价电子排布为6s26p2;根据洪特规则,电子在能量相同的轨道上排布时,电子优先排布在不同的轨道上,且自旋方向相同,铅原子核外6p轨道上的2个电子未成对;
(2)Zn和Ga处于同一周期,锌原子价电子为3d104s2,镓位于周期表中第四周期第ⅢA,价电子排布式为4s24p1,Zn的4s能级处于全充满状态,较稳定,所以锌的第一电离能大于镓的第一电离能;
(3)(I)Na2CO3、NaHCO3属于离子化合物,所以Na2CO3·NaHCO3·2H2O是离子晶体;H2O中氧原子的价电子对数是![]() ,VSEPR模型为四面体;
,VSEPR模型为四面体;
(Ⅱ)Na2CO3是离子晶体,存在离子键、共价键,存在的作用力类型主要有离子键、共价键;CO32-中C原子的价电子对数是![]() ,C原子杂化方式是sp2;
,C原子杂化方式是sp2;
(4)CN一的原子数是2、价电子数是14,与CN一互为等电子体的离子有![]() ;单键为σ键,叁键中有1个σ键和2个π键,HCN的结构式是
;单键为σ键,叁键中有1个σ键和2个π键,HCN的结构式是![]() ,所以HCN分子中σ键和π键数目之比为1:1;
,所以HCN分子中σ键和π键数目之比为1:1;
(5)根据图示,金为面心立方晶胞,金原子配位数是离金原子最近且距离相等的原子数,金原子的配位数是12;根据均摊原则,1个晶胞中金原子数是![]() ,设晶胞的边长是a pm,晶胞的体积是
,设晶胞的边长是a pm,晶胞的体积是![]() ,则
,则![]() ρ,a=
ρ,a=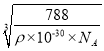 ;金原子半径等于面对角线的
;金原子半径等于面对角线的![]() ,金原子(或粒子)的半径r=
,金原子(或粒子)的半径r=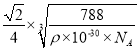 pm。
pm。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。