题目内容
【题目】下表中物质的分类组合正确的是( )
选项 | A | B | C | D |
强电解质 | Al2(SO4)3 | BaSO4 | HF | KClO3 |
弱电解质 | H3PO4 | H2O | CaCO3 | Al(OH)3 |
非电解质 | CO2 | NH3·H2O | NH3 | HI |
A. A B. B C. C D. D
【答案】A
【解析】试题分析:A、正确;B、NH3·H2O属于弱电解质,错误;C、HF属于弱电解质,CaCO3属于强电解质,错误;D、HI属于强电解质,错误。答案选A。

 阅读快车系列答案
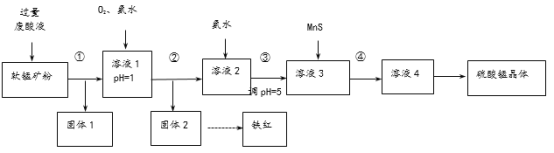
阅读快车系列答案【题目】用软锰矿[主要成分MnO2,还含Fe2O3、Cu2(OH)2CO3及少量不溶于水和酸的杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3),生产过程如下图:
Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 3.6 |
(1)过程①~④所涉及的实验操作方法中,包含过滤的有______(写序号)。
(2)溶液1中,先通入O2,其作用是_______。
(3)由固体2得到铁红的化学方程式是_______。
(4)下列说法正确的是______(填字母)。
a.过程①中有氧化还原反应发生
b.加入MnS的目的是除去溶液中的Cu2+,增大Mn2+
c.溶液1中含有的阳离子主要是Fe2+、Fe3+、Cu2+、Mn2+、H+
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
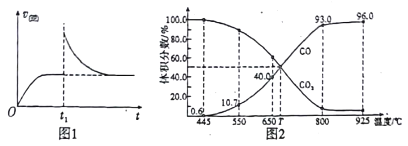
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
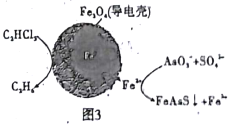
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。