题目内容
 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有漂白、消毒作用的______,相关反应的离子方程式为______.
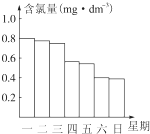
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8:00换水,然后通入氯气消毒,通常游泳池中水的含氯量(有效氯)控制在0.5mg?L-1至1.0mg?L-1之间时,效果最好.图是该小组测定的每天19:00时游泳池中水的含氯量,哪几天使用游泳池不安全?______.
(3)你认为哪几天的天气炎热、阳光强烈______,说出一种理由是______(必要的方程式和文字).
(4)在对游泳池水中通入氯气消毒时,当发生氯气泄漏时,应立即关闭氯气罐,还应采取下列自救方法______.
A.用湿润的毛巾捂住口鼻跑向低处
B.用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C.用浸湿浓氨水的毛巾捂住口鼻匍匐跑至安全处
D.用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
(5)小型游泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液消毒而非氯气的一项理由______;用化学方程式说明工业上如何生产漂白液?______.
解:(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有强氧化性的次氯酸,反应的离子方程式为Cl2+H2O═H++Cl-+HClO,
故答案为:次氯酸;Cl2+H2O═H++Cl-+HClO;
(2)由图中可知,星期六、星期日的含氯量控制在0.5mg/L以下,是不安全的,故答案为:星期六、星期日;
(3)因为阳光强烈时HClO更易分解,致含氯量下降明显,所以导致星期四、星期六的含氯量下降明显,
故答案为:星期四、星期六;2HC1O=2HC1+O2↑阳光强烈时HClO更易分解,致含氯量下降明显;
(4)因Cl2密度比空气大,故人应向高处跑,又因为氯气溶于水时生成的HCl、HClO显酸性,故应用显碱性的物质吸收,考虑到安全性,故可用浸有小苏打或肥皂水的毛巾捂住口鼻,
故答案为:B;
(5)通常使用漂白液(NaClO溶液)而非氯气来消毒池水的原因是:NaClO更稳定,便于储存和运输,工业用氯气和NaOH反应制备漂白液,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:NaClO更稳定,便于储存和运输;Cl2+2NaOH═NaCl+NaClO+H2O.
分析:(1)利用HClO的强氧化性杀菌消毒;
(2)根据图象判断含氯量是否(有效氯)控制在0.5mg?L-1至1.0mg?L-1之间,在之间的较安全;
(3)因为HClO又有光照易分解的性质:2HClO 2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;
2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;
(4)因Cl2密度比空气大,故人应向高处跑,又因为氯气溶于水时生成的HCl、HClO显酸性,故应用显碱性的物质吸收,考虑到安全性,故可用浸有小苏打或肥皂水的毛巾捂住口鼻;
(5)因为HClO的见光不稳定性,因此选用其盐溶液杀菌消毒,效果长久且便于储存和运输.
点评:本题以氯水中HClO的性质为考查对象设置题目,答本题要把图中信息和化学知识有机地结合起来进行分析、判断,从而得出正确的结论,题目难度不大.
故答案为:次氯酸;Cl2+H2O═H++Cl-+HClO;
(2)由图中可知,星期六、星期日的含氯量控制在0.5mg/L以下,是不安全的,故答案为:星期六、星期日;
(3)因为阳光强烈时HClO更易分解,致含氯量下降明显,所以导致星期四、星期六的含氯量下降明显,
故答案为:星期四、星期六;2HC1O=2HC1+O2↑阳光强烈时HClO更易分解,致含氯量下降明显;
(4)因Cl2密度比空气大,故人应向高处跑,又因为氯气溶于水时生成的HCl、HClO显酸性,故应用显碱性的物质吸收,考虑到安全性,故可用浸有小苏打或肥皂水的毛巾捂住口鼻,
故答案为:B;
(5)通常使用漂白液(NaClO溶液)而非氯气来消毒池水的原因是:NaClO更稳定,便于储存和运输,工业用氯气和NaOH反应制备漂白液,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:NaClO更稳定,便于储存和运输;Cl2+2NaOH═NaCl+NaClO+H2O.
分析:(1)利用HClO的强氧化性杀菌消毒;
(2)根据图象判断含氯量是否(有效氯)控制在0.5mg?L-1至1.0mg?L-1之间,在之间的较安全;
(3)因为HClO又有光照易分解的性质:2HClO
 2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;
2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;(4)因Cl2密度比空气大,故人应向高处跑,又因为氯气溶于水时生成的HCl、HClO显酸性,故应用显碱性的物质吸收,考虑到安全性,故可用浸有小苏打或肥皂水的毛巾捂住口鼻;
(5)因为HClO的见光不稳定性,因此选用其盐溶液杀菌消毒,效果长久且便于储存和运输.
点评:本题以氯水中HClO的性质为考查对象设置题目,答本题要把图中信息和化学知识有机地结合起来进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
 MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.
MnCl2+Cl2↑+2H2O(MnO2不能氧化稀盐酸).用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量MnO2充分反应;②用87gMnO2与足量的浓盐酸充分反应.不考虑HCl 挥发,则两种方法生成的氯气的量的是方法①______(填“>”、“<”或“=”)方法②.
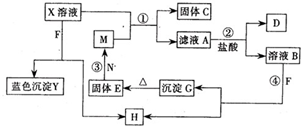 已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).