题目内容
 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是
(2)负极反应式为
(3)电极表面镀铂粉的原因为
考点:原电池和电解池的工作原理
专题:
分析:(1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置;燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极;
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水;
(3)反应物接触面积越大,反应速率越快.
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水;
(3)反应物接触面积越大,反应速率越快.
解答:
解:(1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置,所以该燃料电池中能量主要转化形式是化学能转化为电能;燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极,所以通入氢气的电极是负极、通入氧气的电极是正极,电子流动方向为a到b,
故答案为:化学能→电能;a→b;
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(3)反应物接触面积越大,反应速率越快,电极表面镀铂粉能增大反应物的接触面积,所以能增大反应速率,故答案为:增大反应速率.
故答案为:化学能→电能;a→b;
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(3)反应物接触面积越大,反应速率越快,电极表面镀铂粉能增大反应物的接触面积,所以能增大反应速率,故答案为:增大反应速率.
点评:本题考查原电池原理,侧重考查化学基本理论,明确燃料电池中正负极的判断、电流及离子流向、电极反应式的书写即可解答,注意电极反应式与电解质溶液酸碱性有关,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
已知如下两个热化学反应方程式:下列说法错误的是( )
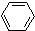 (1)+H2(g)→
(1)+H2(g)→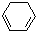 (1)-Q ①
(1)-Q ①
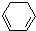 (1)+2H2(g)→
(1)+2H2(g)→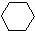 (1)+Q ②
(1)+Q ②
 (1)+H2(g)→
(1)+H2(g)→ (1)-Q ①
(1)-Q ① (1)+2H2(g)→
(1)+2H2(g)→ (1)+Q ②
(1)+Q ②| A、反应①、②都属于加成反应 |
| B、1,3-环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g.下列说法正确的是( )
| A、剩余固体是铁、铜混合物 |
| B、原固体混合物中铜的质量是9.6g |
| C、反应后溶液中n(Fe3+)=0.10 mol |
| D、反应后溶液中n(Fe2+)+n(Cu2+)=0.75 mol |
常温下,pH=a的FeCl3溶液和pH=b的K2CO3溶液中,由水电离的c(H+)相同,则a和b的关系是( )
| A、a=b | B、a>b |
| C、a+b=14 | D、a<14-b |
在空气中久置而不易变质的物质是( )
| A、过氧化钠 | B、纯碱 |
| C、硅酸钠溶液 | D、氯化亚铁溶液 |
下面是四位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
| A、使用冰箱保存食物,是利用了化学反应速率理论 |
| B、化学平衡理论是研究怎样使用有限原料多出产品 |
| C、合成氨工业的反应温度控制在500℃左右,目的是提高单位时间内的产量 |
| D、化学反应速率理论是研究怎样提高原料转化率 |
化学反应中一定伴随着能量的变化,下列有关能量的说法错误的是( )
| A、水的电离是吸热过程 |
| B、任何中和反应都是放热反应 |
| C、电解饱和食盐水时,电能转变成化学能 |
| D、由2H2(g)+O2(g)?2H2O(g)△H=-483.6kj?mol-1,可知的燃烧热为241.8kJ?mol-1 |
化学雕刻法是指用化学药品在一些固体材料表面腐蚀出图案的方法.对以下材料进行化学雕刻,所用药品错误的是( )
| A、用氢氟酸雕刻玻璃 |
| B、用浓硝酸雕刻水晶 |
| C、用三氯化铁溶液雕刻铜板 |
| D、用盐酸雕刻汉白玉 |
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
| B、金属镁与稀盐酸反应 Mg+2H++2 Cl-=MgCl2+H2↑ |
| C、金属钠投入到冷水中 Na+H2O=Na++OH-+H2↑ |
| D、氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O |