题目内容
|
用1 L 1.0 mol/L的NaOH溶液吸收0.8 mol的SO2,所得溶液中的 | |
| [ ] | |
A. |
2∶1 |
B. |
1∶3 |
C. |
3∶2 |
D. |
2∶3 |
答案:B
解析:
解析:
|
解析:设1.0 mol NaOH和0.8 mol SO2反应可生成x mol Na2SO3、y mol NaHSO3和z mol H2O,则可写出该反应的叠加化学反应方程式: 1.0NaOH+0.8SO2=xNa2SO3+yNaHSO3+zH2O 根据Na+、S原子在反应前后物质的量守恒原理可得到下列两个方程: 2x+y=1.0, ① x+y=0.8. ② 联立解得:x=0.2,y=0.6. 故n( 评注:(1)若不用叠加方程式解题,则可根据SO2+2NaOH=Na2SO3+H2O和SO2+NaOH=NaHSO3两个化学反应方程式,通过列方程组求解. (2)常见的叠加反应还有: ①mSO2+nBa(OH)2=xBaSO3↓+yBa(HSO3)2+zH2O ②mCa(OH)2+nCO2=xCaCO3↓+yCa(HCO3)2+zH2O ③mNa2CO3+nHCl=xNaHCO3+yCO2↑+zNaCl+wH2O ④mH2S+nNaOH=xNa2S+yNaHS+zH2O |

练习册系列答案
相关题目
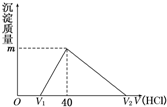 (2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
(2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )


