题目内容
【题目】某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3 , 某同学设计并完成如下实验:(所加试剂均过量)已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色. 请回答: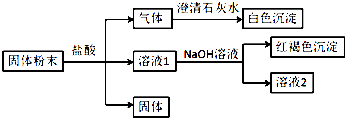
(1)白色沉淀是(填化学式).
(2)生成红褐色沉淀的离子方程式为 .
(3)根据实验现象,固体粉末中一定存在的组分是(填化学式).
【答案】
(1)CaCO3
(2)Fe3++3OH﹣=Fe(OH)3↓
(3)SiO2、Fe2O3、K2CO3
【解析】解:固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3 , 由实验流程可知,加盐酸生成的气体能使石灰水变浑浊,则气体为CO2 , 溶液1与NaOH反应生成红褐色沉淀,沉淀为氢氧化铁,则原固体一定含Fe2O3 , 可知没有CuO,与盐酸反应后得到的固体为SiO2 , 又蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色,为K的焰色反应,则原固体中含K2CO3 , (1)白色沉淀为二氧化碳与氢氧化钙反应生成的CaCO3 , 故答案为:CaCO3;(2分)(2)生成红褐色沉淀的离子方程式为Fe3++3OH﹣=Fe(OH)3↓,故答案为:Fe3++3OH﹣=Fe(OH)3↓;(3)由上述分析可知,一定含SiO2、Fe2O3、K2CO3 , 可能含NaHCO3 , 一定不含CuO,故答案为:SiO2、Fe2O3、K2CO3 . 固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3 , 由实验流程可知,加盐酸生成的气体能使石灰水变浑浊,则气体为CO2 , 溶液1与NaOH反应生成红褐色沉淀,沉淀为氢氧化铁,则原固体一定含Fe2O3 , 可知没有CuO,与盐酸反应后得到的固体为SiO2 , 又蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色,为K的焰色反应,则原固体中含K2CO3 , 以此来解答.