题目内容
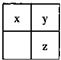 短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( )
短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( )| A、若y和z能形成化合物,则x为氮元素 | B、若x、y、z的单质常温下都是气体,则Y为氧元素 | C、若x、y、z是非金属元素,则它们气态氢化物的水溶液都显酸性 | D、若x、y、z的原子序数之和小于20,则它们都是金属元素 |
分析:x、y、z是短周期主族元素,由在周期表中的相对位置可知,x、y为第二周期元素,z为第三周期元素,y、z同主族,
A.x和z能形成化合物,则y、z可以处于ⅣA、ⅥA族等;
B.x、z的单质常温下都是气体,则x为O、y为F、z为Cl;
C.x、y、z是非金属元素,则x至少处于ⅢA族,x为C或N或O时,其氢化物水溶液不呈酸性;
D.x、y、z的原子序数之和小于20,令y的原子序数为a,则x原子序数为a-1,z的原子序数为a+8,则a+a-1+a+8<20,解得a<
,则y为Be、x为Li、z为Mg,据此解答.
A.x和z能形成化合物,则y、z可以处于ⅣA、ⅥA族等;
B.x、z的单质常温下都是气体,则x为O、y为F、z为Cl;
C.x、y、z是非金属元素,则x至少处于ⅢA族,x为C或N或O时,其氢化物水溶液不呈酸性;
D.x、y、z的原子序数之和小于20,令y的原子序数为a,则x原子序数为a-1,z的原子序数为a+8,则a+a-1+a+8<20,解得a<
| 13 |
| 3 |
解答:解:x、y、z是短周期主族元素,由在周期表中的相对位置可知,x、y为第二周期元素,z为第三周期元素,y、z同主族,
A.若y和z能形成化合物,则y、z可以处于ⅣA、ⅥA族等,若处于ⅥA族,x为N,若处于ⅣA族,则x为B,故A错误;
B.若x、y、z的单质常温下都是气体,则x、y只能处于ⅦA族,则x为O、y为F、z为Cl,故B错误;
C.若x、y、z是非金属元素,则x至少处于ⅢA族,x为C或N或O时,其氢化物水溶液不呈酸性,故C错误,
D.若x、y、z的原子序数之和小于20,令y的原子序数为a,则x原子序数为a-1,z的原子序数为a+8,则a+a-1+a+8<20,解得a<
,则y为Be、x为Li、z为Mg,三者都是金属元素,故D正确,
故选D.
A.若y和z能形成化合物,则y、z可以处于ⅣA、ⅥA族等,若处于ⅥA族,x为N,若处于ⅣA族,则x为B,故A错误;
B.若x、y、z的单质常温下都是气体,则x、y只能处于ⅦA族,则x为O、y为F、z为Cl,故B错误;
C.若x、y、z是非金属元素,则x至少处于ⅢA族,x为C或N或O时,其氢化物水溶液不呈酸性,故C错误,
D.若x、y、z的原子序数之和小于20,令y的原子序数为a,则x原子序数为a-1,z的原子序数为a+8,则a+a-1+a+8<20,解得a<
| 13 |
| 3 |
故选D.
点评:本题考查位置性质关系应用,属于开放性题目,注意元素的不确定性,利用列举法进行的解答,难度不大.

练习册系列答案
相关题目
短周期主族元素X,Y,A,B,C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法不正确的是( )
| X | A | ||
| Y | C | B |
| A、原子半径由小到大的顺序为:A<B<C<Y |
| B、A、B的氢化物的沸点由低到高的顺序为:HA<HB |
| C、X、Y最高价氧化物对应的水化物的酸性由弱到强的顺序为:H2YO3<H2XO3 |
| D、B、C简单离子的还原性由弱到强的顺序为:B-<C 2- |
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如表中所示.下列判断不正确的是( )
| Y | W | |
| X | Z |
| A、原子半径最大的是X |
| B、电负性最大的是W |
| C、Y、Z原子序数差为8 |
| D、氢化物最稳定的是Z |
 短周期主族元素X、Y、Z、W、M在元素周期表中的位置如图,W最高价氧化物对应的水化物为强酸,下列说法正确的是( )
短周期主族元素X、Y、Z、W、M在元素周期表中的位置如图,W最高价氧化物对应的水化物为强酸,下列说法正确的是( )| A、原子半径:Y<Z<M | B、M最高价氧化物对应的水化物一定是强酸 | C、Z与M对应的氢化物的沸点:M>Z | D、一定条件下,M、Y对应的单质都能与W的氢化物发生置换反应 |