题目内容
【题目】氨气是一种重要的化工产品,在生产和科研中应用广泛,氢气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
途径一、用水和天然气作原料一步反应制得
途径二,用煤和水作原料经多步反应制得
请回答下列问题:
(1)途径一反应的还原产物是______。
(2)途径二中的一步反应为:![]()
①上述反应达到平衡后,为提高CO的转化率,下列措施中正确的是______![]() 填写序号
填写序号![]() 。
。
A.增大压强 ![]() 降低温度
降低温度 ![]() 增大
增大![]() 的浓度
的浓度 ![]() 使用催化剂
使用催化剂
②已知1000K时,上述反应的平衡常数![]() ,若要使CO的转化率超过
,若要使CO的转化率超过![]() ,则起始时
,则起始时![]() :
:![]() 不低于______。
不低于______。
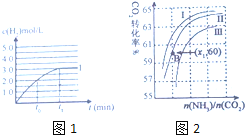
③在容积为2L的容器中发生上述反应,测得![]() 与反应时间t的变化曲线Ⅰ如图1所示,若在
与反应时间t的变化曲线Ⅰ如图1所示,若在![]() 时刻将容器的体积扩大至4L,请在答题卡图中绘出
时刻将容器的体积扩大至4L,请在答题卡图中绘出![]() 与反应时间变化的曲线Ⅱ。____________
与反应时间变化的曲线Ⅱ。____________
(3)目前常用氨气处理硝酸生产的工业尾气,在![]() 左右且有催化剂存在的情况下,氨气能把
左右且有催化剂存在的情况下,氨气能把![]() 还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为
还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为![]() ,
,![]() ,
,![]() 。试写出氨气与
。试写出氨气与![]() 反应生成无毒气体和液态水的热化学方程式______。
反应生成无毒气体和液态水的热化学方程式______。
(4)工业上用氨和二氧化碳反应合成尿素,其反应为:CO2+2NH3=CO(NH2)2+H2O;![]() 生成过程中,原料气常混有水蒸气,
生成过程中,原料气常混有水蒸气,![]() 的转化率与氨碳比
的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系如图2所示:
的变化关系如图2所示:
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是______。
②若B点氨的转化率为![]() ,则
,则![]() ______。
______。
(5)某同学将![]() 和
和![]() 按物质的量之比2:1通入水中,充分反应所得溶液中
按物质的量之比2:1通入水中,充分反应所得溶液中![]() 、
、![]() 、
、![]() 三种离子浓度由大到小的顺序是______
三种离子浓度由大到小的顺序是______![]() 已知:氨水、碳酸的电离平衡常数如表
已知:氨水、碳酸的电离平衡常数如表![]()
弱电解质 | 化学式 | 电离常数 |
氨水 |
|
|
碳酸 |
|
|
|
【答案】氢气 ![]()
![]()

![]() Ⅰ
Ⅰ ![]()
![]()
【解析】
(1)途径一是用水和甲烷作原料一步反应制得氢气,氢元素的化合价降低,所以氢气是还原产物;
(2)①A.增大压强,![]() 平衡不会发生移动,CO转化率不变,故不选A;
平衡不会发生移动,CO转化率不变,故不选A;
B.降低温度,![]() 平衡正向进行,CO转化率增大,故选B;
平衡正向进行,CO转化率增大,故选B;
C.增大水蒸气的浓度,![]() 平衡向着正方向进行,CO转化率增大,故选C;
平衡向着正方向进行,CO转化率增大,故选C;
D.催化剂不会引起化学平衡的移动,CO转化率不变,故不选D;
故选BC;
②设CO的起始浓度为xmol,![]() 的起始浓度为ymol,则转化的CO的最小值为
的起始浓度为ymol,则转化的CO的最小值为![]() ,
,

根据平衡常数列式:![]() ,解得
,解得![]() ,故此只要此值大于
,故此只要此值大于![]() ,转化率就会超过
,转化率就会超过![]() ;
;
③体积增大2倍,浓度缩小2倍,压强变小,但压强对![]() 的平衡无影响,所以达平衡时,氢气的浓度是原平衡的一半,则
的平衡无影响,所以达平衡时,氢气的浓度是原平衡的一半,则![]() 与反应时间变化的曲线Ⅱ:
与反应时间变化的曲线Ⅱ: ;
;
(3)氢气的燃烧热为![]() ,则氢气的燃烧的热化学方程式为:
,则氢气的燃烧的热化学方程式为:
![]()
![]()
![]()
根据盖斯定律①×6-②×2-③×3得![]() ;
;
(4)①根据图2可知,氨碳比一定时,水碳比越大,说明原料气中水的浓度越大,增大水的浓度,CO2+2NH3![]() CO(NH2)2+H2O平衡逆向移动,二氧化碳的转化率降低,所以二氧化碳转化率最大的即为水碳比最小的,则曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是Ⅰ曲线;
CO(NH2)2+H2O平衡逆向移动,二氧化碳的转化率降低,所以二氧化碳转化率最大的即为水碳比最小的,则曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是Ⅰ曲线;
②B点二氧化碳的转化率为![]() ,氨气的转化率是
,氨气的转化率是![]() ,设
,设![]() 、
、![]() 的起始物质的量分别为x、y,则:
的起始物质的量分别为x、y,则:![]() ,解得:
,解得:![]() ;
;
(5)将![]() 和
和![]() 按物质的量之比2:1通入水中,生成碳酸铵溶液,铵根离子和碳酸根离子都水解,铵根离子的水解平衡常数
按物质的量之比2:1通入水中,生成碳酸铵溶液,铵根离子和碳酸根离子都水解,铵根离子的水解平衡常数![]() ,碳酸根的水解平衡常数
,碳酸根的水解平衡常数![]() ,则碳酸根的水解程度大,铵根的水解程度小,溶液中的铵根浓度大于碳酸根,水解是弱水解,碳酸根的浓度大于碳酸氢根,则离子浓度大小关系为:
,则碳酸根的水解程度大,铵根的水解程度小,溶液中的铵根浓度大于碳酸根,水解是弱水解,碳酸根的浓度大于碳酸氢根,则离子浓度大小关系为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】已知SO2可以用Fe(NO3)3溶液吸收,按如图所示装置展开相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。回答下列问题:
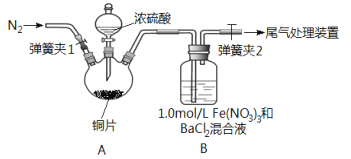
(i)装置A中用于添加浓硫酸的仪器名称为_________________。
(2)实验开始前需进行的操作是_____________________。
(3)加入浓硫酸之前先通入N2一段时间,其目的是_____________________。
(4)排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是_______;若用NaOH溶液处理尾气,则发生反应的离子方程式为_________________。
(5)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加);假设1:装置A中白雾进入装置B中参与了反应;
假设2:______________;
假设3: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2。
(6)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0mol/LFe(NO3)3溶液的pH ②取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中 (3)________________ ④向试管中通入适量SO2气体 | _____________ |
(7)若假设2正确,请写出B中发生反应的离子方程式:_________________。
【题目】合成氨工业中的原料气制取与净化是重要的环节。
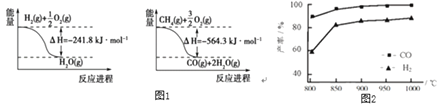
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压