题目内容
【题目】神舟十一号飞船搭乘CZ—2F火箭成功发射,在重达495吨的起飞重量中,95%的都是化学推进剂。
(1)CH3OH和液氧是常用的液体火箭推进剂。
①已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(l) ΔH1
2H2(g)+O2(l)=2H2O(l) ΔH2
CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
则ΔH4=______(用ΔH1、ΔH2、ΔH3来表示)。
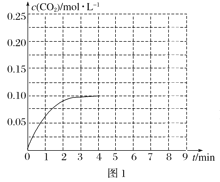
②某温度下,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1molCH3OH和1molH2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数______(保留四位有效数字)。保持其他条件不变,在第5min时向体系中再充入0.2molCO2和0.4molH2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图1中画出5~9min的c(CO2)变化曲线示意图_______。
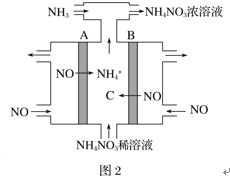
(2)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为______极,请写出在B电极上发生的电极反应式:______。
【答案】3△H22△H12△H3 59.26 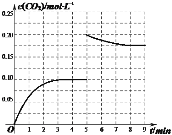 阴 NO3e+2H2O=NO3+4H+
阴 NO3e+2H2O=NO3+4H+
【解析】
(1)①利用盖斯定律:3×②-2×①-2×③得,2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4=3△H2-2△H1-2△H3,据此进行分析;
②CO2(g)+3H2(g) CH3OH(g)+H2O(g),据K=![]() 进行计算;反应物浓度增大,使平衡不断向正反应方向进行,据此作图;
进行计算;反应物浓度增大,使平衡不断向正反应方向进行,据此作图;
(2)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极,B极上NO生成NO3-,发生氧化反应,据此书写电极反应方程式。
(1)①已知:①CO2(g)+3H2(g) CH3OH(g)+H2O(l) ΔH1
②2H2(g)+O2(l)=2H2O(l) ΔH2
③CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
根据盖斯定律,3×②2×①2×③得,2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4=3△H22△H12△H3;
②根据题意,列三段式:
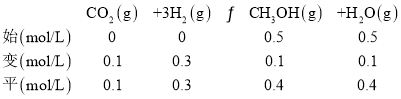
K=![]() ,反应物浓度增大,使平衡不断向正反应方向进行,故图为
,反应物浓度增大,使平衡不断向正反应方向进行,故图为
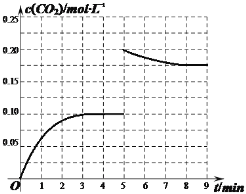 ,
,
(3)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极;B极上NO生成NO3,发生氧化反应,故电极反应方程式为NO3e+2H2O=NO3+4H+。