��Ŀ����
8�����ݿ��ף����ţ��������ι�˾����ѭ�����õķ�չ�������ҵ�ϳɰ����Ʊ��״������������������Ѿ߱����60��ֺϳɰ���38��ּ״�������������������������ͼ1��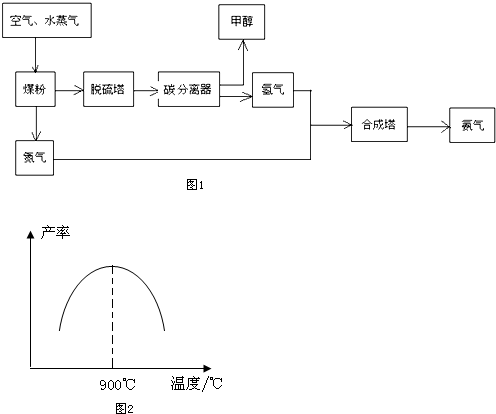
��ش��������⣺
��1����ҵ����ʱ��ˮ��������ú�۷�Ӧ�Ʊ�H2����Ӧ�Ļ�ѧ����ʽΪC+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2��
��2����ҵ��ȡ��������һ����ӦΪ��CO+H2O��g��?CO2+H2����T��ʱ����1L�ܱ������г���0.2molCO��0.3molˮ��������Ӧ��ƽ�����ϵ��c��H2���T0.12mol•L-1�����¶��´˷�Ӧ��ƽ�ⳣ��K=1�������������
��3�����ں��º��ݵ������ڽ��з�ӦCO��g��+2H2 ��g��?C H3OH��g�������ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
| ���� | H2 | CO | C H3OH |
| Ũ��/��mol•L-1�� | 0.20 | o.10 | o.40 |
�ڸ÷�Ӧ�ﵽƽ��״̬�ı�־��BC������ĸ��ţ���
A����1��H-H�����ɵ�ͬʱ��3��C-H������
B��CO�İٷֺ������ֲ���
C�������л�������ѹǿ���仯
D�������л��������ܶȲ��仯
��4����֪�ڳ��³�ѹ�£�
��2C H3OH��l��+3O2 ��g��?2CO2 ��g��+4H2 O��g����H1=-1275.6kJ/mol
��2C O��l��+O2 ��g��?2CO2 ��g����H2=-566.0kJ/mol
��H2O ��g��?H2 O��l����H3=-44.0kJ/mol
д���״�����ȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽCH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ•mol-1��
��5��N2��H2������������145��Ϳ�ʼ��Ӧ����ͬ�¶���NH3�IJ�����ͼ2��ʾ���¶ȸ���900��ʱ��NH3�����½���ԭ�����¶ȸ���900��ʱ��ƽ�������ƶ������������кϳ���Ҫ����ѭ������Ŀ�������ԭ�ϵ������ʣ�
���� ��1��ˮ�����ڸ�������̼��Ӧ����һ����̼�����ˮ���ݴ�д����Ӧ�Ļ�ѧ����ʽ��
��2������ƽ�ⳣ������ʽ�Լ��������ʵ�Ũ�����û�ѧƽ������ʽ���м��㣻
��3�����ȸ��ݱ��м��������״��ķ�Ӧ���ʣ�Ȼ����ݻ�ѧ�������뷴Ӧ���ʳ����ȼ����������ƽ����Ӧ���ʣ�
�ڸ��ݿ��淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�Ȳ��ٱ仯�жϣ�
��4�������Ȼ�ѧ����ʽ���ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ��
��5�����ڷ��ȷ�Ӧ���¶����ߣ���ѧƽ���������ƶ������ѭ�����ÿ������ԭ�ϵ������ʣ�
��� �⣺��1��̼���ڸ�������ˮ������Ӧ�Ļ�ѧ����ʽΪ��C+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2��
�ʴ�Ϊ��C+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2��
��2��CO+H2O��g��?CO2+H2
��ʼ��0.2 0.3 0 0
�仯��0.12 0.12 0.12 0.12
ƽ�⣺0.08 0.18 0.12 0.12
��K=$\frac{0.12��0.12}{0.08��0.18}$=1��
�ʴ�Ϊ��1��
��3�����ɱ������ݿ�֪��l0min�ڼ״���Ũ�ȱ仯Ϊ0.4mol/L����v��CH3OH��=$\frac{0.4mol/L}{10min}$=0.04mol/��L•min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CH3OH��=2��0.04mol/��L•min��=0.08mol/��L•min����
�ʴ�Ϊ��0.08mol/��L•min����
��A����1��H-H�����ɵ�ͬʱ��3��C-H�����ɣ����淴Ӧ���ʲ���ȣ�û�дﵽƽ��״̬����A����
B��CO�ٷֺ������ֲ��䣬֤������ֲ��ٱ仯���÷�Ӧ�Ѿ��ﵽ�˻�ѧƽ��״̬����B��ȷ��
C���÷�Ӧ��һ��ǰ����������仯�ķ�Ӧ�������л�������ѹǿ���仯��֤���ﵽ��ƽ��״̬����C��ȷ��
D��������������غ㣬����㶨�����������л��������ܶȲ��ᷢ���仯����D����
��ѡBC��
��4����2CH3OH��l��+3O2��g��?2CO2��g��+4H2O��g����H1=-1275.6kJ/mol
��2CO��l��+O2��g��?2CO2��g����H2=-566.0kJ/mol
��H2O��g��?H2O��l����H3=-44.0kJ/mol��
���ݸ�˹���ɣ�����֪��Ӧ����-��+�ۡ�4����$\frac{1}{2}$�õ���CH3OH��l��+O2��g��=CO��g��+2H2O��l������H=$\frac{1}{2}$[��-1275.6kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-442.8kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ•mol-1��
��5���¶���900��ʱ����Ӧ�ﵽƽ��״̬���¶ȸ���900��ʱ�����������¶ȣ�ƽ�������ȷ��������ƶ���
���ںϳɰ��ķ�ӦΪ���淴Ӧ�����ѭ������ԭ�ϣ������ԭ�ϵ������ʣ�
�ʴ�Ϊ���¶ȸ���900��ʱ��ƽ�������ƶ������ԭ�ϵ������ʣ�
���� ���⿼�鹤ҵ�ϳɰ�����Ӧ�ã���Ŀ�Ѷ��еȣ�ע����������ʽ������ر��Ǹ�˹���ɵ������Լ�ȼ�ϵ�صĵ缫��Ӧ����д������֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ���ѧ���ķ������������������Ӧ�û���֪ʶ��������

 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�| A�� | �����ǡ���ѿ�Ǿ���������Cu��OH��2��Ӧ | |
| B�� | ���������ʵĶ�����кɵ���������İ����� | |
| C�� | ������ʳ�ؽ�����ʱ���ɺȴ�����ţ�̡�����ⶾ | |
| D�� | ��֬������������Һ��ˮ����Ƶ�����ϴ���õ�Һ����� |
| A�� | ����Ȼ�����Һ�Ĺ����У���Һ��pH��С | |
| B�� | �����������Һ�Ĺ����У������������䣬������������ | |
| C�� | �����������Һ�Ĺ����У�����������������ʵ�������ͬ | |
| D�� | �������������Һ�Ĺ����У��������Ƶ����ʵ���Ũ�ȼ�С |
| A�� |  | B�� | C2H2 | C�� |  | D�� | 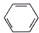 |
| ѡ�� | ʵ�� | ���� | ���ӷ���ʽ |
| A | ���Ȼ�����Һ�еμӹ�����ˮ | �а�ɫ�������� | Al3++3OH-=Al��OH��3�� |
| B | ��FeBr2��Һ��ͨ���������� | ��Һ��dz��ɫ��ɻ�ɫ | 2Fe2++Cl2=2Fe3++2Cl- |
| C | ��ϡ�����м��뵥��Fe�� | ���������� | Fe+6H+=3Fe3++3H2�� |
| D | ��Na2CO3��Һ�еμӷ�̪�Լ� | ��Һ����ɫ��Ϊ��ɫ | CO32-+H2O=H2CO3+2OH- |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | ���ᡢ��ȩ������ | B�� | �������ӡ���ϩ | ||
| C�� | �Ҵ������Ȼ�̼���������� | D�� | �����ױ��������� |
| A�� | ��������װβ�������� | |
| B�� | �ı���ȼ�շ�ʽʹֲ�����ϵķ��� | |
| C�� | ��������Դ�����ٻ�ʯȼ�ϵ�ʹ�� | |
| D�� | ���齫���з��糧����������Ǩ������ |
| A | B | C | D | |
| ���ʵĻ�ѧʽ | CCl4 | NaOH | CH3OH | NH4NO3 |
| Σ�վ����ʶ | ��ȼƷ | ��ʴƷ | �ж�Ʒ | ��ըƷ |
| A�� | A | B�� | B | C�� | C | D�� | D |
 ���γɸû�����Ļ�ѧ�������Ӽ����ۼ�
���γɸû�����Ļ�ѧ�������Ӽ����ۼ�