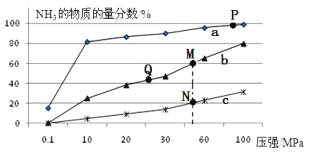
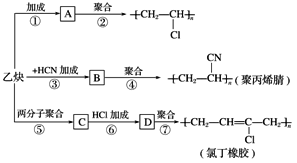
��Ŀ����
����Ŀ�����г����µ�������Һ����0.01molL��1 CH3COOH��Һ����0.01molL��1 HCl��Һ����pH=12�İ�ˮ����pH=12��NaOH��Һ����0.01molL��1 CH3COOH��Һ��pH=12�İ�ˮ�������Ϻ�������Һ����0.01molL��1 HCl��Һ��pH=12��NaOH��Һ��������������Һ��
��1������ˮ�ĵ���̶�������__________������ţ���ͬ����ˮ�ĵ���̶���ͬ����_____________________��
��2�������ڢۻ�Ϻ�������Һ��pH=7����������Һ���������_____�ۣ�������������������=������
��3����������Һͬ��ϡ��10������Һ��pH����_____������_____������_____�ޣ�������������������=������
��4�����٢ܻ�ϣ�����c��CH3COO������c��H+����������Һ���ܳ�___________������ţ���
A������ B������ C�����ԣ�
���𰸡��� �ڢۢ� �� �� �� �� ABC
��������
��1��ˮ����������ʣ����ڵ���ƽ��H2O![]() H����OH�������ݵ���������ӿ�֪����������ˮ�ĵ��룬�������ˮ�����Ǵٽ�ˮ�ĵ��롣pH=12�İ�ˮ��˵����ˮ��Ũ�ȴ���0.01mol/L���������а�ˮ�ǹ����ģ�������Һ�Լ��ԡ������ж���ǡ�÷�Ӧ�����Ȼ��ƣ��Ȼ����Dz��ܷ���ˮ��ģ������ڸ���Һ��ˮ�ĵ���û�б����ƣ������٢ڢۢܢ��о�������ˮ�ĵ���ġ���Ϊ�ڢۢ���H��Ũ�Ȼ�OH����Ũ�Ⱦ���0.01mol�����Զ�ˮ�ĵ������Ƴ̶�����ͬ�ġ�
H����OH�������ݵ���������ӿ�֪����������ˮ�ĵ��룬�������ˮ�����Ǵٽ�ˮ�ĵ��롣pH=12�İ�ˮ��˵����ˮ��Ũ�ȴ���0.01mol/L���������а�ˮ�ǹ����ģ�������Һ�Լ��ԡ������ж���ǡ�÷�Ӧ�����Ȼ��ƣ��Ȼ����Dz��ܷ���ˮ��ģ������ڸ���Һ��ˮ�ĵ���û�б����ƣ������٢ڢۢܢ��о�������ˮ�ĵ���ġ���Ϊ�ڢۢ���H��Ũ�Ȼ�OH����Ũ�Ⱦ���0.01mol�����Զ�ˮ�ĵ������Ƴ̶�����ͬ�ġ�
��2����pH=12�İ�ˮ��˵����ˮ��Ũ�ȴ���0.01mol/L�������ڢ��������Ϻ�ˮ��������Һ�Լ��ԣ�Ҫʹ��Һ�����ԣ���������������ڰ�ˮ�������
��3�����������ϡ�������Ǵٽ�����ģ������ӵ����ʵ��������ӵġ���ǿ���������Һ�в����ڵ���ƽ�⣬���ϡ��ʱ���ӵ����ʵ����Dz���ġ��٢�ϡ����ͬ��������ߵ�Ũ����Ȼ��ȣ�����pHǰ�ߴ��ۢ�ϡ��ǰpH��ȣ���ϡ�ͺ�����OH�������ʵ���Ҫ�������еģ�����pH��ǰ�ߴ�ϡ��ǰ���Լ��ԣ��������ԣ�����ϡ�ͺ���Ȼ��ǰ�ߵ�pH��
��4���٢���Ϻ��ݵ���غ��֪c(H��)��c(Na��)��c(OH��)��c(CH3COO��)����c(CH3COO��)��c(H��)����c(Na��)��c(OH��)����c(H����c(OH��)�Ĵ�С��ϵ��ȷ�������Ը���Һ���������ԡ����Ի����ԡ�

 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д� �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�