题目内容
把铝粉和氧化铁粉配成铝热剂,分成两等份.一份在高温下恰好完全反应后,再与足量盐酸起反应;另一份放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体的质量比是
- A.1:1
- B.2:3
- C.3:2
- D.28:9
B
分析:把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知,n(H2)=n(Fe);令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),据此计算判断.
解答:把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知,n(H2)=n(Fe),所以n(H2)=n(Al);
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=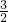 3n(Al).
3n(Al).
故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=n(Al):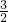 3n(Al)=2:3,
3n(Al)=2:3,
故选B.
点评:本题考查混合物的计算、根据方程式的计算,难度中等,本题采取电子转移守恒计算,比根据方程式简单容易,清楚反应过程是关键,注意混合物的计算中守恒的运用.
分析:把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知,n(H2)=n(Fe);令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),据此计算判断.
解答:把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知,n(H2)=n(Fe),所以n(H2)=n(Al);
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=
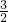 3n(Al).
3n(Al).故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=n(Al):
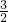 3n(Al)=2:3,
3n(Al)=2:3,故选B.
点评:本题考查混合物的计算、根据方程式的计算,难度中等,本题采取电子转移守恒计算,比根据方程式简单容易,清楚反应过程是关键,注意混合物的计算中守恒的运用.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目