题目内容
10.下列反应中,属于放热反应的是①②③⑥,属于吸热反应的是④⑤.①燃烧反应 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤Ba(OH)2•8H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应.
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2)、少数置换反应(如C和H2O)、某些复分解(如铵盐和强碱)和碳、一氧化碳、氢气等还原金属氧化物.
解答 解:①燃烧放出热量,属于常见的放热反应;
②炸药爆炸要放出热量,属于放热反应;
③酸与碱的中和反应要放热热量,属于常见的放热反应;
④二氧化碳通过炽热的碳属于吸热反应;
⑤Ba(OH)2•8H2O与NH4Cl反应属于常见的吸热反应;
⑥铁粉与稀盐酸反应属于金属与酸反应,属于放热反应;
故答案为:①②③⑥;④⑤.
点评 本题考查吸热反应、放热反应,难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
相关题目
20.某溶液中有NH4+、Ca2+、Mg2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中浓度变化最大的离子是( )
| A. | NH4+ | B. | Ca2+ | C. | Mg2+ | D. | Al3+ |
18.下列物质中,化学键类型(离子键、共价键)完全相同的是( )
| A. | HI和NaI | B. | NaF和NaOH | C. | Na2SO4和KNO3 | D. | F2和NaCl |
5. 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放热(填“吸热”或“放热”)反应.
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.已知:C(s)+O2(g)?CO2(g)△H=-393kJ•mol-1;
2CO (g)+O2(g)?2CO2(g)△H=-566kJ•mol-1;
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为C(s)+H2O(g)=CO (g)+H2(g)△H=+132 kJ•mol-1.
(2)将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
②实验1中,0~4min时段内,以v(H2)表示的反应速率为0.8mol/(L•min).
③实验2达到平衡时CO的转化率为20%.
④实验3与实验2相比,改变的条件是加催化剂;
请在如图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注.
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,
还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 $\frac{\underline{\;通电\;}}{\;}$2CO+O2,若阳
极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O.
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3.
15.按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )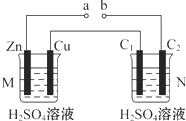

| A. | a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 | |
| B. | a、b连接,装置M中若有0.1 mol SO42-移到Cu电极,装置N中C2极放出H2 2.24 L(标准状况) | |
| C. | a、b未连接时,装置N中C1电极上有气体析出 | |
| D. | 不论a、b是否连接,装置M中观察到的实验现象相同 |
2.下列说法正确的是( )
| A. | 共价键都具有方向性 | |
| B. | σ键是镜像对称,而π键是轴对称 | |
| C. | π键是由两个p电子“肩并肩”重叠形成的 | |
| D. | σ键 都是由两个p轨道“头碰头”重叠形成的 |
19.下列混合物能用分液法分离的是( )
| A. | 乙醇与乙酸 | B. | 苯和硝基苯 | ||
| C. | 乙酸乙酯和Na2CO3溶液 | D. | 乙醛与水 |
3.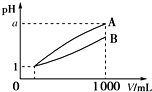 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |