题目内容
【题目】常温下,HNO2的电离常数Ka=7.1×10-4,NH3·H2O的电离常数Kb=1.7×10-5。0.1 mol·L-1 NH4NO2溶液中,离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
【答案】c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】
Ka>Kb,说明NH4NO2溶液中铵根离子的水解大于亚硝酸根离子的水解,则c(NO2-)>c(NH4+),溶液呈酸性,据此判断0.1 mol/LNH4NO2溶液中离子浓度由大到小的顺序;
NO2-水解的离子方程式为NO2-+H2O![]() HNO2+OH-,结合常温下NO2-水解反应的平衡常数K计算。
HNO2+OH-,结合常温下NO2-水解反应的平衡常数K计算。
常温下,HNO2 的电离常数Ka=7.1×10-4 molL-1,NH3H2O的电离常数Kb=1.7×10-5 molL-1,Ka>Kb,则NH4NO2溶液中铵根离子的水解大于亚硝酸根离子的水解,则c(NO2-)>c(NH4+),水解最终使溶液呈酸性,c(H+)>c(OH-),故0.1 molL-1NH4NO2溶液中离子浓度由大到小的顺序是:c(NO2-)>c(NH4+)>c(H+)>c(OH-);
NO2-水解的离子方程式为NO2-+H2O![]() HNO2+OH-,结合常温下NO2-水解反应的平衡常数Kh=
HNO2+OH-,结合常温下NO2-水解反应的平衡常数Kh=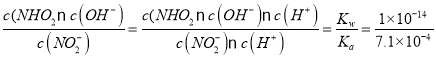 =1.4×10-11。
=1.4×10-11。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目