题目内容
下列说法正确的是( )
| A.铅蓄电池放电时铅电极发生还原反应 |
| B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠 |
| C.给铁钉镀铜可采用CuSO4作电镀液 |
| D.生铁浸泡在食盐水中发生析氢腐蚀 |
C
解析

练习册系列答案
相关题目
下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关的判断正确的是
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
下列叙述中不正确的是:
| A.金属的电化学腐蚀比化学腐蚀普遍 |
| B.钢铁在干燥空气里不易腐蚀 |
| C.用铝质铆钉来接铁板,铁板易被腐蚀 |
| D.金属腐蚀的本质是M-ne-=Mn+而被损耗 |
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是
①通入CH4的电极为正极 ②正极的电极反应式为O2+2H2O+4e-=4OH- ③通入CH4的电极反应式为CH4+2O2+4e-=CO2+2H2O ④负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
某原电池装置如图所示。下列有关叙述中,正确的是( )
| A.Fe作正极,发生氧化反应 |
| B.负极反应:2H++2e-=H2↑ |
| C.工作一段时间后,两烧杯中溶液pH均不变 |
| D.工作一段时间后,NaCl溶液中c(Cl-)增大 |
1 L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
A.电解后溶液的pH=0 B.a=3
C.阳极生成1.5 mol Cl2 D.阴极析出的金属是铜与铝
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=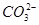 +8H+ +8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体 |
关于如图所示装置的叙述,正确的是( )
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |