题目内容
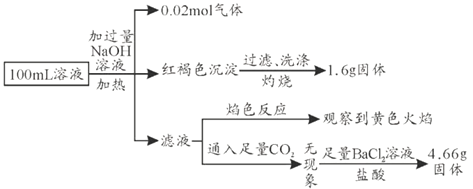
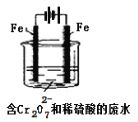
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
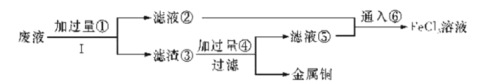
(1)写出下列物质的化学式①___、⑥___。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:_______。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为__色沉淀,此过程所涉及反应的化学方程式为:______、___。
(5)通入⑥发生反应的离子方程式:________。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___(填字母代号)。
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无
【答案】Fe Cl2 过滤 2Fe3++Cu=2Fe2++Cu2+ 红褐 FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl- B
【解析】
从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,由流程可知,①为Fe,发生Fe+CuCl2=Cu+FeCl2,3FeCl3+Fe=3FeCl2,I为过滤,铁粉过量,则滤液②为FeCl2,滤渣③中含Fe、Cu,加过量④为盐酸,过滤得到金属Cu,滤液③中含FeCl2、HCl,为不引入杂质,将铁的化合物全部转化为FeCl3溶液,则通入⑥为氯气,以此来解答。
(1)根据分析,①为Fe,⑥为氯气;
(2)根据分析,步骤I为过滤;
(3)FeCl3溶液与铜箔发生反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:反应生成白色沉淀,后迅速变为灰绿色,接着又转化为红褐色沉淀,此转化的化学方程式为FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)⑥发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(6)A.Fe的还原性大于Cu,所以加入Fe、Cu时Fe先参加反应,当Fe完全反应后、Cu部分反应,则烧杯中有Cu无Fe,故A不符合题意;
B.Fe的还原性大于Cu,所以加入Fe、Cu时Fe先参加反应,如果溶液中有Fe而无铜,则Fe会和铜离子发生置换反应,所以不可能出现有Fe而无Cu现象,故B符合题意;
C.如果铁完全将铁离子还原还剩余,则Cu就不参加反应,所以烧杯中还剩Fe、Cu,故C不符合题意;
D.如果铁离子的量足够多,Fe、Cu完全反应后铁离子还剩余,则烧杯中Cu、Fe都不存在,故D不符合题意;
故答案为B。

【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D