题目内容
2.写出下面反应的化学方程式(1)过氧化钠与水的反应2Na2O2+2H2O=4NaOH+O2↑
(2)氯气与水的反应Cl2+H2O?HCl+HClO
(3)钠在空气中燃烧2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2.
分析 (1)过氧化钠与水反应生成NaOH和氧气;
(2)氯气与水反应生成HCl、HClO;
(3)钠在空气中燃烧生成过氧化钠.
解答 解:(1)过氧化钠与水反应生成NaOH和氧气,该反应为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)氯气与水反应生成HCl、HClO,化学反应方程式为Cl2+H2O?HCl+HClO,故答案为:Cl2+H2O?HCl+HClO;
(3)钠在空气中燃烧生成过氧化钠,反应的方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2.
点评 本题考查化学方程式的书写,注意把握书写方法和注意事项,题目较简单.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
13.下列应用与盐类的水解无关的是( )
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | 氢氧化钠 | C. | 盐酸 | D. | 豆浆 |
7.下列物质分类正确的是( )
| A. | SO2、SO3、CO2均为酸性氧化物 | |
| B. | 稀豆浆、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 氨水、漂白粉、氢氟酸、小苏打均为纯净物 |
14.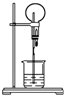 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |