题目内容
6.在标准状况下,1体积水溶解了500体积的氨气,得到的密度为0.9g/mL.的氨水,示这种氨水的质量百分比浓度和物质的量浓度?分析 NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,设水的体积为1L,则氨气的体积为500L,由标准状况下的体积可计算氨气的物质的量,溶液质量=氨气质量+水的质量,溶液体积可由溶液的质量和密度来计算,再根据质量分数定义、物质的量浓度的定义计算.
解答 解:NH3溶于水后虽然大部分生成NH3•H2O,但在计算时,仍以NH3作为氨水中的溶质,
设水的体积为1L,氨气的体积为700L,则氨气的物质的量为$\frac{500L}{22.4L/mol}$=22.32mol,
溶液的质量为1000g+22.32mol×17g/mol=1379.464g,
溶液的体积为$\frac{1379.464g}{0.9g/mL}$=1532.74mL,
则氨水的质量分数为w=$\frac{22.32mol×17g/mol}{1379.464g}$×100%=27.51%,
氨水的物质的量浓度为c=$\frac{22.32mol}{1.533L}$=14.56 mol/L,
答:这种氨水的质量百分比浓度为27.51%,物质的量浓度14.56 mol/L.
点评 本题考查学生物质的量浓度和质量分数的计算,难度中等,溶液的体积计算是解答本题的关键也是学生解答本题的易错点,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
12.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A. | 铁在氯气中燃烧,生成棕红色的烟 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
13.某温度时,a mol•L-1一元酸HA与b mol•L-1NaOH等体积混合后,pH为7,则下列说法正确的是( )
| A. | a<b | B. | a>b | ||
| C. | c (A-)=c(Na+) | D. | 以上情况都有可能 |
10. 某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
 某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )| A. | 图中T2一定大于T1 | |
| B. | 图中b点速率一定大于d点速率 | |
| C. | 达到平衡时,A2的转化率大小为:c>b>a | |
| D. | 加入催化剂可以使状态d变为状态b |
1.卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按图所示流程进行生产,可制得轻质氧化镁.
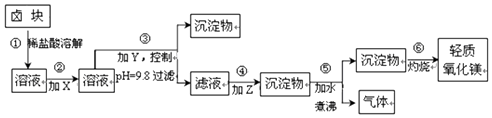
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd( 选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.

| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| 资*源%库Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd( 选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.
11.如图所示的各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有( )

| A. | ①②④⑤ | B. | ②③④⑤ | C. | ②④⑤ | D. | ③④ |
18.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 将氢氧化铁放入盐酸中:Fe(OH)3+3H+═Fe3++3H2O |
15.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3、HD、CH4 | B. | HCl、CO2、H2SO4 | C. | SO2、SiO2、P2O5 | D. | CCl4、Na2S、H2O |
16.下列有关钠的化合物说法正确的是( )
| A. | 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 | |
| B. | 用加热法除去NaHCO3固体中混有的Na2CO3 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+ | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |