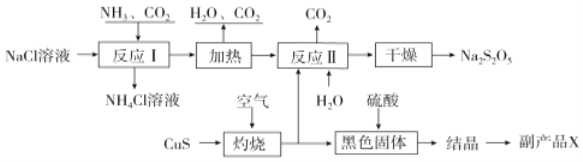
题目内容
【题目】(1)0.3molNH3分子中所含氢原子数与___个H2O分子中所含氢原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的物质的量是___。
(3)2.3gNa中含___mole-,在跟足量水反应中失去___mole-。
(4)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______。
【答案】2.709×1023 0.6 mol 1.1 0.1 ![]() L
L
【解析】
(1)0.3molNH3中含有H原子0.9mol,1个水分子中含有2个H原子,则水分子中需要含有相同数目的H原子数需要0.9mol/2=0.45molH2O,则水分子的个数为0.45mol×6.02×1023mol-1= 2.709×1023;
(2) Al2(SO4)3中Al3+和SO42-的物质的量的比例为2:3,Al3+含有0.4mol,则SO42-含有0.4mol÷2×3=0.6mol;
(3)Na为11号元素,1molNa原子中含有11mol电子,2.3gNa为0.1molNa,则含有0.1×11 mol =1.1mol电子。2Na+2H2O=2NaOH+H2↑,Na原子变成Na+,1molNa失去1mol电子,则0.1molNa与水反应失去0.1mol电子;
(3)利用连等式![]() ,ag某气体中含有的分子数为b,有
,ag某气体中含有的分子数为b,有![]() ,cg该气体在标准状况下的体积V,有
,cg该气体在标准状况下的体积V,有![]() ,VM=22.4L/mol,求出V需要知道M。根据
,VM=22.4L/mol,求出V需要知道M。根据![]() ,得
,得![]() ,带入
,带入![]() ,得V=
,得V=![]() L。
L。

 学习实践园地系列答案
学习实践园地系列答案【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
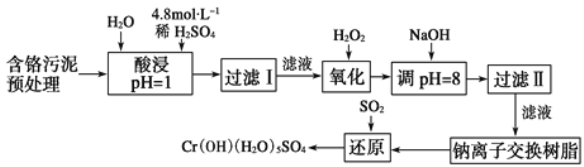
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。