题目内容
【题目】合理应用和处理含氮的化合物,在生产生活中有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示。
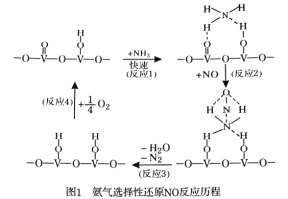
写出总反应化学方程式 。
(2)已知N2(g)+3H2(g)![]() 2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。
2NH3(g) △H=-94.4gKJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示。

①在2L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 。
②25min时采取的措施是 。
③时段III条件下,反应的平衡常数表达式为 (只列计算表达式,不计算)。
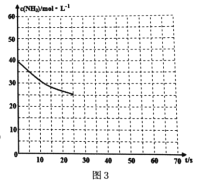
(3)用氨气制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g);△H<0。某温度下,向容器为0.1L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。图3中的曲线表示在前25s内NH3的浓度随时间的变化而变化。其他条件不变,请在图3中用实线画出使用催化剂后c(NH3)随时间的变化曲线。
【答案】(1)4NH3+4NO+O2=4N2+6H2O
(2)①0.050molL-1min-1 (2分,无单位扣1分) 94.4kJ (2分)![]()
② 将NH3从反应体系中分离出去(2分)
![]()

【解析】(1)由图示可判断氨气将NO还原成N2时还有O2参加,且NH3和O2的物质的量之比为4:1因此总反应化学方程式为;4NH3+4NO+O2=4N2+6H2O。
(2)①在2L容器中发生反应,前20min内,v(NH3)=1/20=0.050molL-1min-1,消耗了2molNH3,放出的热量为94.4KJ。
②25min时H2、N2继续减少,NH3的量由0开始增加,采取的措施是将NH3从反应体系中分离出去。
③时段III条件下,各物质的物质的量为:c(H2)=0.75mol/L,c(N2)=0.25mol/L ,c(NH3)=0.50mol/L,平衡常数K=0.502/(0.25×0.753)。
(3)使用催化剂后加快了反应速率,到达平衡所需时间短,但不影响平衡,CO2的转化率仍为50%,由此可画出曲线:


 备战中考寒假系列答案
备战中考寒假系列答案【题目】用下图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系正确的一组是
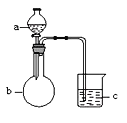
选项 | a | b | c | 现象 | 结论 |
A | 饱和食盐水 | 碳化钙 | 溴水 | c中溶液黄色褪去 | 乙炔发生还原反应 |
B | 浓盐酸 | KMnO4固体 | NaBr溶液 | c中溶液由无色变橙色 | Cl2的氧化性比Br2强 |
C | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
D | 硫酸 | Na2SO3固体 | 酸性KMnO4溶液 | c中溶液紫色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D