题目内容
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
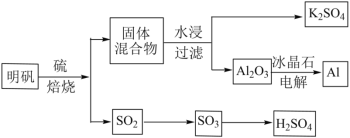
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
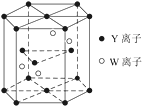
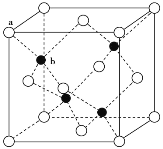
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
【答案】1:1 蒸发浓缩,冷却结晶 4 ![]() V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
【解析】
(1)根据焙烧明矾方程式,判断出氧化剂和还原剂,即可知道答案;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法;
(3)AlN的晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,顶点白色球与相邻黑色距离为晶胞体对角线的
=4,顶点白色球与相邻黑色距离为晶胞体对角线的![]() ,则晶胞体对角线长为4apm,晶胞棱长为
,则晶胞体对角线长为4apm,晶胞棱长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() pm)3,1mol晶胞的质量为4×41g,得其密度;
pm)3,1mol晶胞的质量为4×41g,得其密度;
(4) SO2分子中S原子价层电子对数=2+![]() =3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型及分子的空间构型;
=3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型及分子的空间构型;
(5) ①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依据盖斯定律③-①-②得到。
(1)4KAl(SO4)212H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价。硫酸根离子中硫元素化合价从+6价变化为+4价,故还原剂是硫单质,而氧化剂是6mol的硫酸根离子,即3mol的4KAl(SO4)212H2O,氧化剂和还原剂的物质的量之比1:1,故答案为1:1;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法,故答案:蒸发浓缩,冷却结晶;
(3)AlN的晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,顶点白色球与相邻黑色距离为晶胞体对角线的
=4,顶点白色球与相邻黑色距离为晶胞体对角线的![]() ,则晶胞体对角线长为4apm,晶胞棱长为
,则晶胞体对角线长为4apm,晶胞棱长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() pm)3,1mol晶胞的质量为4×41g,得其密度
pm)3,1mol晶胞的质量为4×41g,得其密度![]() g/cm3,故答案为:4;
g/cm3,故答案为:4;![]() ;
;
(4)SO2分子中S原子价层电子对数=2+![]() =3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型为sp2,分子的空间构型为V形,故答案为:V形或角形;
=3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型为sp2,分子的空间构型为V形,故答案为:V形或角形;
(5)①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304 kJ/mol,即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-152 kJ/mol;故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol。

【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失