题目内容
【题目】现有下列物质:①He;②N2;③H2O2;④CaO;⑤NaHCO3;⑥NH4Cl;⑦Na2O2;⑧SiO2;⑨MgCl2;⑩KOH。请用序号填空:
(1)只含离子键的物质是______________;
(2)只含共价键的物质是______________;
(3)既含离子键又含共价键的物质是______________;
(4)只含极性键的物质是______________;
(5)既含离子键又含非极性键的物质是______________;
(6)不存在化学键的物质是______________;
(7)属于离子化合物的是______________;
(8)属于共价化合物的是______________。
【答案】④⑨ ②③⑧ ⑤⑥⑦⑩ ⑧ ⑦ ① ④⑤⑥⑦⑨⑩ ③⑧
【解析】
一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种原子形成的是非极性共价键,不同种原子形成的是极性共价键,含离子键的一定为离子化合物,据此分析解答。
①He为单原子分子,不含化学键,属于单质;
②N2的电子式为![]() ,结构中含N≡N共价键,属于单质;
,结构中含N≡N共价键,属于单质;
③H2O2的电子式为![]() ,结构中H原子与O原子形成极性共价键,氧原子与氧原子形成非极性共价键,属于共价化合物;
,结构中H原子与O原子形成极性共价键,氧原子与氧原子形成非极性共价键,属于共价化合物;
④CaO的电子式为![]() ,结构中钙离子与氧离子形成离子键,属于离子化合物;
,结构中钙离子与氧离子形成离子键,属于离子化合物;
⑤NaHCO3中Na+与HCO3-之间形成离子键,HCO3-中存在极性共价键,属于离子化合物;
⑥NH4Cl的电子式为 ,结构中NH4+与Cl-之间形成离子键,铵根中氮原子与氢原子之间形成极性共价键,属于离子化合物;
,结构中NH4+与Cl-之间形成离子键,铵根中氮原子与氢原子之间形成极性共价键,属于离子化合物;
⑦Na2O2的电子式为![]() ,结构中钠离子与过氧根形成离子键,过氧根中氧原子与氧原子之间形成非极性共价键,属于离子化合物;
,结构中钠离子与过氧根形成离子键,过氧根中氧原子与氧原子之间形成非极性共价键,属于离子化合物;
⑧SiO2属于原子晶体,结构中Si原子与氧原子形成极性共价键,属于共价化合物;
⑨MgCl2的电子式为![]() ,结构中镁离子与氯离子形成离子键,属于离子化合物;
,结构中镁离子与氯离子形成离子键,属于离子化合物;
⑩KOH的电子式为![]() ,结构中钾离子与氢氧根形成离子键,氢氧根中氧原子与氢原子形成极性共价键,属于离子化合物;
,结构中钾离子与氢氧根形成离子键,氢氧根中氧原子与氢原子形成极性共价键,属于离子化合物;
(1)只含离子键的物质是:④⑨;答案为④⑨。
(2)只含共价键的物质是:②③⑧;答案为②③⑧。
(3)既含离子键又含共价键的物质是:⑤⑥⑦⑩;答案为⑤⑥⑦⑩。
(4)只含极性键的物质是:⑧;答案为⑧。
(5)既含离子键又含非极性键的物质是:⑦;答案为⑦。
(6)不存在化学键的物质是:①;答案为①。
(7)属于离子化合物的是:④⑤⑥⑦⑨⑩;答案为④⑤⑥⑦⑨⑩。
(8)属于共价化合物的是:③⑧;答案为③⑧。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
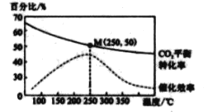
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。