题目内容
【题目】某小组同学欲探究NH3的催化氧化反应,按如图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。

(1)NH3催化氧化的化学方程式是____。
(2)甲、乙两同学分别按如图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是___。
②乙观察到装置F中只有白烟生成,白烟的成分是___(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:___。
(3)为帮助乙实现在装置F中也观察到红棕色气体,如何改进___。
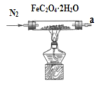
(4)为实现该反应,也可用如图所示的装置替换原装置中虚线框部分。
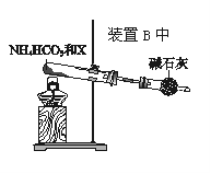
化合物X为__;NH4HCO3的作用是__。
【答案】4NH3+5O2![]() 4NO+6H2O 2NO+O2=2NO2 NH4NO3 3Cu+8H++2NO
4NO+6H2O 2NO+O2=2NO2 NH4NO3 3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O 通过控制K1、K2,增加氧气的量或减少氨气的量[或在E、F之间增加一个吸水(干燥)装置] Na2O2 NH4HCO3受热分解放出NH3;放出的CO2和H2O分别与Na2O2反应生成O2
=3Cu2++2NO↑+4H2O 通过控制K1、K2,增加氧气的量或减少氨气的量[或在E、F之间增加一个吸水(干燥)装置] Na2O2 NH4HCO3受热分解放出NH3;放出的CO2和H2O分别与Na2O2反应生成O2
【解析】
探究NH3的催化氧化反应,需制取NH3和O2,从所给药品可以看出,制氨气采用的方法是将浓氨水滴入NaOH固体中,利用NaOH溶于水放热,降低氨气在水中的溶解度,从而产生氨气,然后用碱石灰干燥,所以应使用B、D装置;制取O2的方法是将H2O2溶液滴入MnO2固体中,利用MnO2的催化作用,使H2O2分解生成O2,然后用浓硫酸干燥,所以应使用A、C装置。干燥的NH3、O2在E中混合并在催化剂、加热条件下发生反应生成NO和H2O,若O2过量,NO会转化为NO2,进而与水反应生成HNO3和NO,若此时NH3有剩余,此会生成NH4NO3。在E中,NO与O2作用生成NO2,通入G装置中,NO2与水作用生成HNO3,与稀硫酸和铜片作用生成Cu(NO3)2等,余气需进行处理,以防污染环境。若用NH4HCO3制原料气,需将分解生成的CO2和H2O转化为O2,所以需使用Na2O2。
(1)NH3催化氧化生成NO和H2O,化学方程式是4NH3+5O2![]() 4NO+6H2O。答案为:4NH3+5O2
4NO+6H2O。答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①甲观察到装置F中有红棕色气体(NO2),说明反应后O2有剩余,剩余的O2将NO氧化,化学方程式是2NO+O2=2NO2。答案为:2NO+O2=2NO2;
②乙观察到装置F中只有白烟生成,则表明NO2与H2O反应生成的HNO3与NH3反应,所以白烟的成分是NH4NO3。答案为:NH4NO3;
③装置G中溶液变成蓝色,说明反应生成了Cu2+,则应为NO2和水作用生成的HNO3与稀硫酸及铜片作用生成Cu(NO3)2等,产生此现象的离子方程式为:3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O。答案为:3Cu+8H++2NO
=3Cu2++2NO↑+4H2O。答案为:3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O;
=3Cu2++2NO↑+4H2O;
(3)为帮助乙实现在装置F中也观察到红棕色气体,则需减少NH3的生成量,增大O2的生成量,所以应改进为:通过控制K1、K2,增加氧气的量或减少氨气的量[或在E、F之间增加一个吸水(干燥)装置]。答案为:通过控制K1、K2,增加氧气的量或减少氨气的量[或在E、F之间增加一个吸水(干燥)装置];
(4)若用NH4HCO3制原料气,需将分解生成的CO2和H2O转化为O2,所以需使用Na2O2,所以化合物X为Na2O2;NH4HCO3的作用是NH4HCO3受热分解放出NH3;放出的CO2和H2O分别与Na2O2反应生成O2。答案为:Na2O2;NH4HCO3受热分解放出H3;放出的CO2和H2O分别与Na2O2反应生成O2。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案