题目内容
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)操作①加热的目的是________________,
(2)操作②除用BaCl2溶液外,还可用____________替代。
(3)操作②,判断SO42-已除尽的方法是________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是____________。
(5)操作④的名称是______________,应在________(填仪器名称)中进行。
【答案】加热分解除去NH4HCO3 Ba(OH)2溶液 取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽 除去过量的Ba2+ 减少一次过滤操作 蒸发结晶 蒸发皿
【解析】
(1)化合物中碳酸氢铵受热分解分析;
(2)操作②是沉淀硫酸根离子的作用,也可以加入氢氧化钡溶液,注意不能引入新的杂质;
(3)判断SO42-已除尽选择的试剂是BaCl2溶液;
(4)操作③是除去过量的钡离子;
(5)操作④是蒸发氯化钠溶液得到氯化钠晶体,溶液蒸发在蒸发皿中加热进行。
(1)操作①加热的目的是利用碳酸氢铵受热分解生成氨气、二氧化碳、水蒸气除去碳酸氢铵固体;故答案为:加热分解除去NH4HCO3;
(2)操作②是完全沉淀硫酸根离子,原则是加入的试剂不能引入新的杂质,或最后易于除去,除了用BaCl2溶液外,也可以用Ba(OH)2溶液;
(3)操作②,判断SO42-已除尽的方法是取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽;
(4)操作③是加入碳酸钠溶液,目的是除去过量的钡离子,避免引入钡离子杂质;所以加入碳酸钠的目的是除去过量的Ba2+;不先过滤后再加Na2CO3溶液的理由是减少一次过滤操作;
(5)操作④将溶液蒸发结晶得到溶质晶体;操作④是将氯化钠溶液蒸发结晶得到氯化钠晶体,溶液蒸发应在蒸发皿中加热进行。

 阅读快车系列答案
阅读快车系列答案【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
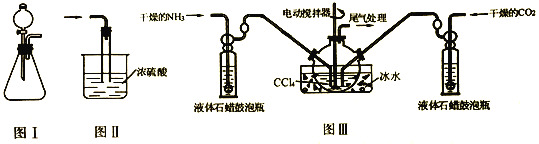
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
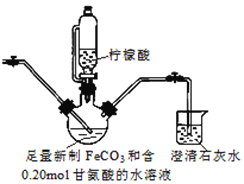
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。