题目内容
加入少许下列一种物质,不能使溴水颜色变浅的是
| A.Mg粉 | B.H2S(g) | C.KI(s) | D.CCl4 |
C
解析试题分析:A. Mg+Br2=MgBr2,Mg+2HBr=MgBr2+H2↑ 同样溴水变浅。其中HBr是Br2和水反应的产物;B.H2S(g) 具有还原性,可以和溴水发生氧化还原反应,而造成溴水褪色;C.Br2+2I-=I2+2Br-碘的颜色比溴深。所以不行;D.CCl4可以萃取单质溴,颜色变浅。
考点:考查化学反应,物质的化学变化。

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
在下列用途或反应中,硫酸表现出的性质为:
| A.高沸点性; | B.酸性; | C.吸水性; | D.脱水性;(E)强氧化性。试用字母填空: |
(3)将浓硫酸加到浓盐酸中产生白雾:__________;
(4)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑:______________。
如图所示装置,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶中,然后打开止水夹,不能出现“喷泉现象”,则物质a、b对应的选项是
| 选项 | a(干燥气体) | b(液体) |
| A | NO | H2O |
| B | Cl2 | 饱和NaCl溶液 |
| C | SO2 | 浓NaOH溶液 |
| D | NH3 | H2O |
科学家发现微量硫化氢可以调节心血管功能。有关硫化氢的叙述正确的是
| A.硫化氢很稳定,受热难分解 |
| B.将硫化氢通入氯水中,氯水褪色并产生浑浊 |
| C.硫化氢在足量氧气中燃烧生成淡黄色固体 |
| D.硫化氢是弱电解质,其电离方程式是H2S ? 2H+ + S2- |
Na2O2、Cl2和SO2均能使品红溶液褪色(NA为阿伏加德罗常数的值)。下列说法正确的是
| A.Na2O2、Cl2、SO2使品红溶液褪色的原理相同 |
| B.标准状况下,1 mol Na2O2和22.4LCO2反应,转移电子数目为NA |
| C.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 |
| D.在Na2O2中阴阳离子所含的电子数目相等 |
某化学小组用下图所示装置制取氯气,下列说法不正确的是
| A.该装置图中至少存在两处明显错误 |
| B.烧瓶中的MnO2可换成KMnO4 |
| C.在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
| D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
| A.应先打开活塞再从右侧加稀硝酸 |
| B.左侧稀硝酸须注满 |
| C.关闭活塞后铜丝会全部溶解 |
| D.反应停止后打开活塞气体变成红棕色 |
下列有关氯气的叙述中不正确的是( )
| A.氯气是一种黄绿色,有刺激性气味的气体 |
| B.氯气,液氯,氯水是同一种物质 |
| C.氯气能溶于水 |
| D.氯气是一种有毒气体 |
(13分)硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、、Na2SO4、NaHSO4 |
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。
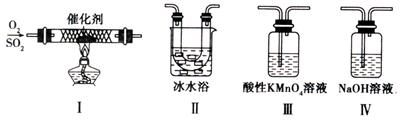
①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。