题目内容
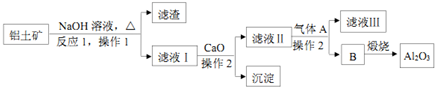
 已知A为金属单质,根据如图物质的变化,回答:
已知A为金属单质,根据如图物质的变化,回答:(1)各物质的化学式:
A.
B.
C.
D.
E.
(2)写出①-⑥有关变化的化学方程式(离子反应书写离子方程式).
考点:无机物的推断
专题:
分析:金属A与氢氧化钠、稀硫酸反应,则A为Al,A与氯气反应生成B为AlCl3,B与氨水反应生成C,而C与氢氧化钠反应生成E,且A与氢氧化钠反应也生成E,故C为Al(OH)3,E为NaAlO2,A与硫酸反应生成D,结合D与C的消耗转化可知,D为Al2(SO4)3,据此解答.
解答:
解:(1)金属A与氢氧化钠、稀硫酸反应,则A为Al,A与氯气反应生成B为AlCl3,B与氨水反应生成C,而C与氢氧化钠反应生成E,且A与氢氧化钠反应也生成E,故C为Al(OH)3,E为NaAlO2,A与硫酸反应生成D,结合D与C的消耗转化可知,D为Al2(SO4)3,
故答案为:Al;AlCl3;Al(OH)3;Al2(SO4)3;NaAlO2;
(2)反应①的化学方程式为:2Al+3Cl2
2AlCl3,
反应②的离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
反应③的离子方程式为:2Al+6H+=2Al3++3H2↑,
反应④的离子方程式为:Al3++3OH-=Al(OH)3↓,
反应⑤的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
反应⑥的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
答:反应①的化学方程式为:2Al+3Cl2
2AlCl3,
反应②的离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
反应③的离子方程式为:2Al+6H+=2Al3++3H2↑,
反应④的离子方程式为:Al3++3OH-=Al(OH)3↓,
反应⑤的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
反应⑥的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
故答案为:Al;AlCl3;Al(OH)3;Al2(SO4)3;NaAlO2;
(2)反应①的化学方程式为:2Al+3Cl2
| ||
反应②的离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
反应③的离子方程式为:2Al+6H+=2Al3++3H2↑,
反应④的离子方程式为:Al3++3OH-=Al(OH)3↓,
反应⑤的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
反应⑥的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
答:反应①的化学方程式为:2Al+3Cl2
| ||
反应②的离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
反应③的离子方程式为:2Al+6H+=2Al3++3H2↑,
反应④的离子方程式为:Al3++3OH-=Al(OH)3↓,
反应⑤的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
反应⑥的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查有机物推断,注意根据金属A能与硫酸、氢氧化钠反应进行推断,侧重对化学用语的考查,注意对基础知识的全面掌握,难度不大.

练习册系列答案
相关题目
下列说法或表示方法正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、一CH3(甲基)的电子式: |
C、硝基苯的结构简式: |
D、聚乙烯的结构简式为: |
现有下列短周期元素性质的数据:下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A、原子序数④元素小于⑦元素 |
| B、上述八种元素最高价氧化物对应的水化物,⑤号酸性最强 |
C、⑧号元素离子结构示意图为: |
| D、②、③处于同一周期 |
某无色透明溶液中,能大量共存的离子组是( )
| A、Cu2+、Na+、SO42-、Cl- |
| B、Ba2+、Na+、OH-、SO42- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、K+、Na+、OH-、NO3- |