题目内容
时刻向密闭容器中加入A、B、C三种气体,保持一定温度,在t1、t2、t3、t4各时刻测得各物质的浓度如表所示.据此推断以下各说法中不正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol?L- | 6 | 3 | 2 | 2 |
| c(B)/mol?L- | 5 | 3.5 | 3 | 3 |
| c(C)/mol?L- | 1 | 2.5 | 3 | 3 |
| A、在t3时刻反应已经停止 | ||
| B、达到平衡时A的转化率比B的转化率大 | ||
| C、在容器内发生的反应为2A+B?C | ||
D、在t2~t3时间段内A的平均反应速率为
|
分析:从表中数据可以看出,反应没有进行到底,所以这是一个可逆反应,然后根据反应的物质的量之比等于化学计量数之比可得反应方程式,以此进行分析;
A、t3时刻达到了平衡状态,反应没有停止;
B、根据反应方程式求出起始时物质A、B的物质的量浓度,然后根据转化率公式求出各自的转化率;
C、根据物质的量的变化以及反应的物质的量之比等于化学计量数之比可得反应方程式;
D、根据公式V=
求算A的反应速率;
A、t3时刻达到了平衡状态,反应没有停止;
B、根据反应方程式求出起始时物质A、B的物质的量浓度,然后根据转化率公式求出各自的转化率;
C、根据物质的量的变化以及反应的物质的量之比等于化学计量数之比可得反应方程式;
D、根据公式V=
| △C |
| △t |
解答:解:从表中数据可以看出,反应没有进行到底,所以这是一个可逆反应,表中的数据,t1→t2,消耗了A3mol/L、B1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+B?C;
A、可逆反应达到了平衡状态,反应仍然进行,没有停止,故A错误;
B、t3时刻达到了平衡状态,由方程式2A+B?C,可知反应前A的浓度为8mol/L、B为6mol/L,A的转化率为
×100%=75%,B的转化率为
×100%=50%,故达到平衡时A的转化率比B的转化率大,故B正确;
C、由表中的数据,t1→t2,消耗了A 3mol/L、B 1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+B?C,故C正确;
D、在t2~t3时间段内,A的浓度变化为1mol/L,时间为(t3-t2),故A的平均反应速率为v(A)=
mol?L-1?s-1,故D正确;
故选:A.
A、可逆反应达到了平衡状态,反应仍然进行,没有停止,故A错误;
B、t3时刻达到了平衡状态,由方程式2A+B?C,可知反应前A的浓度为8mol/L、B为6mol/L,A的转化率为
| 6mol/L |
| 8mol/L |
| 3mol/L |
| 6mol/L |
C、由表中的数据,t1→t2,消耗了A 3mol/L、B 1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+B?C,故C正确;
D、在t2~t3时间段内,A的浓度变化为1mol/L,时间为(t3-t2),故A的平均反应速率为v(A)=
| 1 |
| (t3-t2) |
故选:A.
点评:本题考查化学平衡问题和速率的计算,掌握相关化学平衡的特征以及方程式的判断是解题的关键,注意反应达到平衡状态,反应没有停止,难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
(2012?大兴区一模)一定条件下,向密闭容器中加入 X物质,发生反应3X(g)?Y(g)+Z(g)△H<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是( )
|
一定条件下,向密闭容器中加入X物质发生反应:3X(g)  Y(g)
+ Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g)
+ Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
|
反应时间(min) |
0 |
5 |
15 |
17 |
20 |
|
X的浓度(mol·L-1) |
1.0 |
0.4 |
0.4 |
0.7 |
0.7 |
A.0~5 min时,该反应的速率为v(X)=0.12 mol·L-1·min-1
B.5 min时反应达到平衡,该温度下的平衡常数值为0.625
C.15 min时改变的条件可能是降低温度
D.从初始到18 min时,X的转化率为30 %
 2SO3(g)
△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )
2SO3(g)
△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )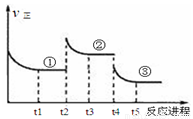
 2SO3(g)
△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是
2SO3(g)
△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是